Capítulo 5 - Angiografía digital
5.1 Generalidades
La utilización de los rayos X continua siendo hoy en día la prueba diagnóstica de elección para el estudio de árbol vascular. La aplicación de contraste intravascular durante la fluoroscopía hace que podamos identificar con detalle cada vaso del cuerpo, detectar patología intrínseca del mismo y conocer la repercusión hemodinámica de la misma.
Existen diversas formas de aplicación de los rayos x como método de diagnostico por imagen para el estudio de la vascularización, así por ejemplo, la incorporación de la tecnología multicorte en el TC, ha condicionado que en la práctica médica diaria, el AngioTC, compita de forma directa con la angiografía digital, que continúa siendo el “gold standard”.
Otros métodos de apoyo al estudio de los vasos incluyen la ecografía y la AngioRM, en ocasiones, sustituta del AngioTC en el diagnostico de la patología vascular.
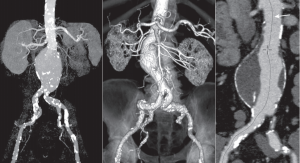
Fig.1 AngioTC Aorta abdominal. Serie de 3 imágenes que muestran reformateo multiplanar MPR, volumen rendering 3D (VR) y estudio vascular avanzado (AVA) en el estudio de un aneurisma abdominal. El post-procesado de imagen nos permite valorar el interior del vaso (flecha).
La arteriografía, por otro lado, es paso inicial imprescindible para el tratamiento de enfermedades vasculares, característica que la colocan a la cabeza de las técnicas de imagen.
Finalmente, dedicaremos un espacio a la descripción de la flebografía, como estudio de la creciente patología venosa y a la linfografía convencional, una técnica que estaba prácticamente en desuso y que esta cobrando en la actualidad un moderado grado de protagonismo.
5.2 Arteriografía Diagnóstica
Es una prueba diagnóstica que permite la exploración de las arterias al realizar radiografía de las mismas una vez que se ha inyectado contraste iodado.
La técnica puede realizarse de forma indirecta, tras inyectar contraste desde una vena y bien esperar el retorno arterial (método en desuso) ó forzar el reflujo comprimiendo la vena (técnica muy utilizada para el estudio de las fístulas arteriovenosas en la diálisis).
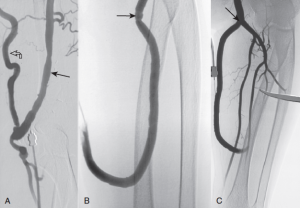
Fig.2 Acceso quirúrgico permanente parahemodiálisis. A. Fístula braquial conformada por graft entre arteria braquial y vena cefálica. La sailda del flujo venoso es comprimida por un clamp durante la inyección de contraste , permitiendo la visualización de la vena (flecha recta) yel flujo de entrada arterial (flecha curva). B. Injerto vascular antebraquial. La inyección de contraste muestra la anastomosis venosa sin alteraciones (flecha) pero no se consigue ver la parte proximal ni el aporte arterial con su anastomosis. C La compresión con un clamp nos permite ver todo el segmento proximal y la anastomosis arterial.
Actualmente y excepto en el estudio de las FAV de hemodiálisis, el estudio se realizará de forma directa, tras acceder directamente a la arteria elegida.
El acceso vascular arterial se continúa realizando hoy en día en base a la técnica desarrollada por Seldinger en los años 50. Mediante este procedimiento somos capaces de introducir un medio de contraste, habitualmente iodado, en cualquier vaso de la anatomía. La utilización de inyectores nos permiten modular volumen y flujo de contraste, que nos permite no sólo estudiar las características anatómicas del vaso sino también su comportamiento hemodinámico. La técnica de acceso vascular necesita del uso de una aguja, una guía y un catéter.
5.2.1 Acceso Vascular
5.2.1.1 Técnica
Habitualmente, elegiremos el acceso arterial que mas nos convenga en función de la localización anatómica que queramos estudiar, ó de los métodos terapéuticos que queramos aplicar. El acceso mas usado por localización, calibre y facilidad de compresión tras el procedimiento, es la arteria femoral común derecha. Pero otros accesos se usan con bastante frecuencia, como son las arterias radiales, humerales ó la femoral común izquierda.
En procedimientos terapéuticos complejos, realizados normalmente por equipos multidisciplinares, se pueden utilizar, previa disección quirúrgica, las arterias subclavias ó arterias femorales, con el fin de poder utilizar materiales de gran calibre (Prótesis aórticas, TAVI, etc…). En función de la dirección de la punción, el acceso puede ser retrógrado, contrario al flujo sanguíneo (el más habitual, al tener menos tasa de complicaciones) o anterógrado, a favor del flujo arterial, normalmente reservado para acciones terapeúticas.
Cualquier punción arterial debe ser realizada bajo anestesia local, con el fin de evitar al máximo el disconfort en el paciente. Para el acceso en la femoral común, el lugar de punción de la arteria debe de ser sobre la cabeza femoral, con el fin de evitar la bifurcación superficial-profunda, facilitar la compresión manual tras el procedimiento (es necesario comprimir el acceso unos 10-15min contra un plano duro, normalmente un hueso) y concentrar las complicaciones en un plano de acceso quirúrgico.
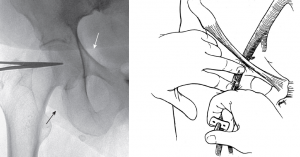
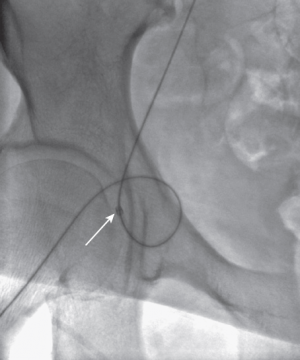
Fig.3Punción de arterial femoral común.Una vez que se identifica el pulso de la AFC (marcado por instrumental quirúrgico bajo fluoroscopia) es necesario delimitar la zona de punción, entre el pliegue cutáneo (flecha negra) y el ligamento inguinal (flecha blanca). De forma especular se muestra un dibujo que muestra como se realiza la punción.
Si el acceso vascular se realiza tanto por encima (pasado el ligamento inguinal), como por debajo (bifurcación superficial-profunda), corremos el riesgo de perder el apoyo necesario para que la compresión sea efectiva y aumentamos la probabilidad de tener complicaciones (hemorragia y pseudoaneurisma como complicaciones más frecuentes).
Existen distintas maneras de localizar el punto idóneo de punción. En primer lugar intentaremos localizarlo por el pulso, mediante la palpación. De esa manera además, evaluaremos como de efectiva será la compresión posterior.
Actualmente la ecografía va ganando popularidad como ayuda en la punción arterial percutánea, al permitir evitar placas de ateroma y facilitar una sola punción de una sola pared. En caso de no disponer de ecografía y que el pulso femoral sea débil, tenemos la posibilidad de realizar la punción guiada por fluoroscopia, reconociendo la pared cálcica de la arteria femoral común superponiéndose a la cabeza del fémur.
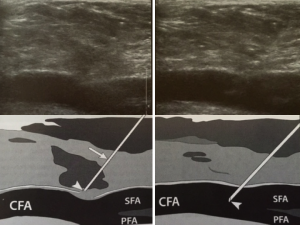
Fig.4 Acceso arteria femoral común con guía ecográfica.Las imágenes en el plano superior muestran cortes ecográficos en modo B siguiendo el plano longitudinal de la arteria femoral común mientras se accede con la aguja de punción a la arteria. Los dibujos del plano inferior delimitan mejor el trayecto de la aguja (flecha) y el bisel de la punta (cabeza de flecha).
La aguja debe entrar formando un ángulo de unos 45º en la dirección que hayamos elegido, bien sea guiada por el latido que estemos palpando, la guía ecográfica o la fluoroscopía. El tamaño y calibre de la aguja dependerán del paciente y de su situación clínica. En pacientes con coagulopatía, en los que debemos evitar la formación de hematoma y en pacientes en edad pediátrica, se deben de usar sets de micropunción, con agujas de 21G, y microguía de 0.018”.
Habitualmente se utilizan agujas de 18G o abocath, a través de las cuales de puede introducir una guía de 0.035” o 0.038”. Si tenemos dudas en este punto, es importante comprobar previamente la compatibilidad de tamaño de los dispositivos.
Una vez alcanzada la arteria, que reconoceremos por la salida de sangre roja de forma pulsátil, debemos introducir con cuidado la guía por la parte de su punta blanda o “floppy”, con el fin de evitar lesiones en la íntima a su entrada en la arteria. La guía debe de avanzarse de forma suave hacia la aorta abdominal. Sobre la guía se debe colocar un introductor que habitualmente va montado sobre un dilatador progresivo, para evitar desgarro en la arteria. Con el introductor adecuadamente colocado, podremos trabajar introduciendo los catéteres y las guías que necesitemos según nuestro propósito.
El acceso arterial anterógrado lleva los mismos pasos que acabamos de ver, con alguna singularidad. La altura de la punción sobre la cabeza femoral suele ser la misma, por lo que hay que tener en cuenta que en pacientes obesos, la punción puede atravesar gran cantidad de grasa antes de llegar a la arteria. Es por tanto necesario calcular la profundidad. Debemos intentar que el ángulo de ataque sea menor de 45º, dado que la propia superficie abdominal suele obligar a realizar punciones más verticales. Esta situación es frecuentemente responsable del “kinking” de catéteres o del propio introductor antes de su acceso a la arteria.
Fig.5 Kinking de un introductor del 5-French durante el acceso a la arteria femoral común en un paciente obeso con ingle postquirúrgica. El espesor de las partes blandas impidió al operador detectar el volteo de la guía y de la vaina del introductor. Tras predilatar con un dilatador de 7-French se pudo colocar un nuevo introductor de 5-French.
Además, debemos tener presente que al pinchar “a favor de flujo”, existe un riesgo añadido de disección no autolimitada de la intima.
El resto de accesos arteriales más frecuentes, radiales, humerales y axilar, suelen precisar de guía ecográfica, dado el pequeño calibre ó la localización anatómica de los mismos. Tienen el inconveniente de que suelen ser arterias menos fijas a planos, por lo que presentan mayor movilidad a la hora de la punción. Este hecho, se puede evitar fijándolas con el transductor del ecógrafo ó con el pulpejo de los dedos.
La compresión posterior debe ser contra hueso, por lo que debemos prestar especial atención a pacientes obesos o muy musculazos. En ellos la posibilidad de desarrollarse un hematoma, es mayor. La formación del propio hematoma dificulta a su vez la compresión, completando el circulo vicioso.
5.2.1.2 Contraindicaciones
La punción arterial para establecer un acceso de estudio angiográfico, está contraindicada en segmentos con un pseudoaneurisma, un hematoma ó infección activa en el lugar de punción. Entre las contraindicaciones relativas tenemos la cirugía reciente en el área de punción, ateromatosis calcificada intensa en el segmento que queremos puncionar, la HTA no controlada y estados de coagulopatía no controlable.
5.2.2 Uso del arco de fluoroscopia: sustracción digital
La adquisición de imágenes se realiza mediante un equipo de fluoroscopia que permite la visualización en tiempo real. Existen dos modalidades de obtención de la imagen: la fluoroscopia o “escopia”, que se caracteriza por ofrecer peor calidad de imagen al obtenerse con menor dosis de radiación. El otro modo de imagen es la sustracción digital angiográfica. Variedad que ofrece mucho mayor detalle, se obtiene con mayor dosis de radiación y según los equipos, discreto post-procesado de la imagen.
La obtención de una serie angiográfica es la versión utilizada en la arteriografía diagnóstica. El procedimiento se inicia en cada serie con la toma de una máscara inicial de la estación anatómica de estudio que luego se utilizará para restar de cada imagen con contraste obtenida en el mismo punto (sustracción). La finalidad de la sustracción digital es evaluar los vasos de forma exclusiva.
Fig.6 Angiografía con sustracción digital. A. Imagen substraída de angiografía de la vena cava inferior. Las flechas muestran múltiples defectos de repleción en su interior. B. La misma imagen sin sustracción digital superpone a la cava ,la columna, otras estructuras óseas de la pelvis y la densidad de las partes blandas junto con el gas intestinal. Esta imagen pone de manifiesto que los defectos de repleción corresponden al cemento radiopaco de vertebroplastias en distintos somas vertebrales.
Para la realización de un estudio angiográfico óptimo que permita un buen estudio diagnóstico y terapeútico es necesario prestar atención a ciertos detalles:
1. Es necesario optimizar la posición del intensificador de rayos X.
2. Usar los métodos de colimación.
3. Optimizar la posición de la mesa.
4. Realizar el cálculo de retraso de la adquisición (en función de la distancia del punto de inyección de contraste / localización anatómica a estudiar).
Como en cada técnica de imagen que utilice las radiaciones ionizantes, la realización de una angiografía, exige limitar al máximo la dosis de rayos X utilizada en beneficio del paciente y del operador, respetando al máximo los criterios ALARA (As Low As Reasonably Achievable).
Finalmente, la conformación del arco de escopia debe de proporcionar movilidad de la fuente de rayos X con el fin de poder obtener imágenes con múltiples angulaciones. Estos ángulos nos permitirán obtener imágenes desplegadas de vasos superpuestos. Actualmente, los equipos mas modernos, disponen de novedosas aplicaciones del arco de fluoroscopia como el roadmap, la angiografía rotacional o el DynaCT, que facilitan, optimizan y mejoran los resultados de los procedimientos.
5.2.3 Uso del contraste iodado
El contraste yodado es un agente de contaste radiopaco que permite obtener la imagen de los vasos.
En función del calibre del vaso a estudiar, la amplitud del territorio distal que vasculariza, la necesidad de retorno venoso y la distancia entre el punto de inyección y la zona de estudio distal, se utilizarán distintos valores de flujo y volumen de contraste en la inyectora:
- Aorta: flujo 15-20 ml/seg; volumen 20-30 ml
- Arterias Ilíacas comunes/externas: flujo 5-10 ml; volumen 20 ml
- Arteria mesentérica/tronco celíaco: flujo 5 ml/seg; volumen 20 ml
- Arteria renal/hepática/esplénica/hipogástricas: flujo 4-5 ml/seg; volumen 15 ml
- Arteria distal: flujo 3 ml/seg; volumen 10-12 ml
Es necesario optimizar la administración de contraste iodado para evitar, en la medida de lo posible, la sobrecarga renal y evitar situaciones de fallo renal transitorio. Como norma general no se debería administrar un volumen de contraste que supere más de un 20-30% del peso del paciente. Así por ejemplo, en un paciente de 85 kg, la dosis máxima aproximada debería estar cercana a 110-120 ml al finalizar el procedimiento.
Las inyecciones de contraste en territorios “delicados” (troncos distales, vasos viscerales ó intralesionales) se suelen hacer manualmente ó controlando la presión (PSI) de la inyectora. Este valor también tiene que tenerse en cuenta en función de la presión máxima que soporta el catéter o microcatéter que estemos empleando. (Este dato suele venir reflejado en el pabellón de conexión del catéter).
5.2.4 Complicaciones
Como anteriormente avanzábamos, las complicaciones mas frecuentes asociadas al procedimiento, incluyen:
- Hematoma: superficial o retroperitoneal. El primero aparece por una compresión fallida en el punto de punción. Habitualmente tiene un curso autolimitado y no suele requerir mas intervención que una adecuada compresión del punto de punción, incluso con el transductor ecográfico en modo Doppler color para confirmar localización. En el segundo caso, el riesgo es mucho mayor ya que suelen ser sangrados que pasan desapercibidos hasta que se ha perdido una gran cantidad de sangre y pueden llegar a resultar fatales sin una pronta actuación. Suelen ser debidos a punciones excesivamente elevadas, por encima de la cabeza femoral, lo que dificulta su compresión y control posterior. Suelen requerir un acceso contralateral, o al menos distinto al que ha provocado el hematoma. Si tras hemostasia con balón el defecto sigue permeable, puede llegar a necesitar incluso su oclusión con un stent recubierto.
- Pseudoaneurisma: Ocurre en el 1% aproximadamente de las punciones arteriales y se produce por una mala compresión, que resulta parcialmente efectiva. Se diagnostica fácilmente con el Doppler color, que muestra la típica imagen en “ying-yang”.
- Fístula arteriovenosa: aparece habitualmente por una punción baja, dado que la vena femoral puede disponerse en una situación algo mas posterior que la arteria, y ser puncionada inadvertidamente. Suelen tener escasa repercusión y de forma excepcional aumentan su tamaño y generan un alto flujo que condicione cierto grado de fallo cardiaco. Se diagnostica fácilmente con el Doppler color y pulsado, evidenciando la conexión entre los dos vasos y una pérdida de la onda trifásica en la arteria debido al flujo de salida.
- Embolismo aéreo: es una complicación que debemos tener siempre presente cuando puncionemos cualquier vaso, pero con mayor motivo si se trata de una arteria y especialmente cuidadosos en estamos trabajando en territorio vascular proximal a los troncos supraaórticos y SNC.
5.3 Flebografía Diagnóstica
Es una prueba diagnóstica que permite la exploración de las venas al realizar radiografía de las mismas una vez que se ha inyectado contraste iodado.
En la práctica clínica habitual la mayor parte de flebografías diagnósticas se realizan para estudio de las venas de extremidades, circuito de salida (venoso) en fístulas de hemodiálisis y estudio de la vena gonadal en el varicocele masculino y la insuficiencia venosa pélvica femenina. Todos estos estudios requieren punción directa de la vena.
Fig.7 Venografía digital directa. Mediante acceso venosos periférico se realiza venografía digital directa que muestra oclusión completa de tronco braquiocefálico, vena inominada y cava superior. El paciente es portador de marcapasos izquierdo y tenía historia de múltiples accesos venosos en el lado derecho.
Menos frecuente es la flebografía indirecta. Consiste en esperar el retorno venoso en un territorio anatómico sobre el que primeramente se ha llevado a cabo un estudio arterial. Este tipo de estudios venosos son frecuentes en el territorio portal (cavernomatosis portal, permeabilidad portal en quimioembolización, … etc).
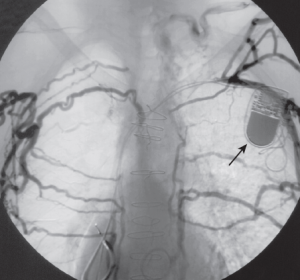
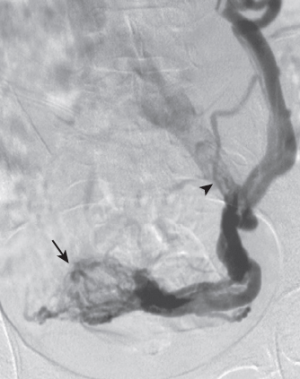
Fig.8 Venografía portal indirecta a partir de inyección arterial de contraste. La imagen muestra angiografía digital substraída a partir de la inyección en la arteria esplénica. El paciente presentaba hipertensión portal con varices gástricas (cabeza de flecha) y shunt sistémico espleno-renal (flecha).
La técnica de flebografía diagnóstica directa permite el estudio del sistema venoso tras una punción venosa. Sin embargo, en función de la localización anatómica y del territorio vascular que se quiera estudiar, se clasificarán en métodos selectivos ó no selectivos.
Antes de describir sus características, debemos tener en cuenta que la inyección de contraste yodado en la vena tiene un comportamiento de flujo contrario al de la arteria. El flujo venoso discurre en dirección al corazón en un territorio de alta capacitancia (gran potencial de colateralidad) y de baja presión.
5.3.1 Flebografía no selectiva
En los estudios no selectivos, se realizan accesos periféricos, desde los que al inyectar el contraste se puede valorar la mayor cantidad de red venosa posible. El ejemplo más claro es la flebografía de los miembros superiores e inferiores. En estos estudios, el acceso se realiza a través de vías periféricas en las venas superficiales de las manos, antebrazos o dorso de los pies. En ocasiones es muy útil ayudarnos de torniquetes con compresores, para evitar la “fuga” de contraste hacia los territorios superficiales, y se rellenen al máximo las venas centrales del territorio a estudiar. No es necesaria una técnica especial para la cateterización de las venas periféricas, y normalmente es el equipo de enfermería, el que se encarga de realizar estos estudios bajo la supervisión del radiólogo vascular.
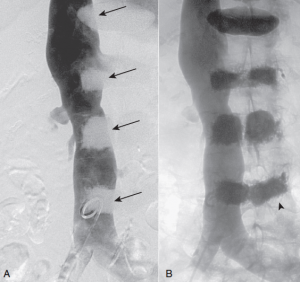
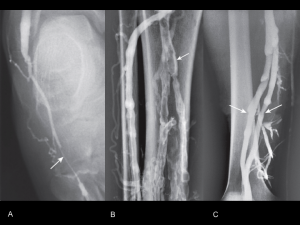
Fig.9 Flebografía clásica de miembros inferiores. A. Flexión plantar de unos 50º y canalización periférica de vena superficial del antepié (flecha). B. La venografía puso de manifiesto la presencia de trombosis. La imagen clásica de trombosis muestra el contraste delimitando el defecto de repleción central (flecha). Se identifica trombo en la vena tibial posterior y venas peroneas.C. El venograma de otro paciente muestra duplicación de la vena poplítea y de la vena femoral superficial en el muslo (flechas).
Las inyecciones de contraste en estos territorios suelen ser manuales, y dependen de la amplitud de territorio a estudiar. Así, para el estudio del miembro superior, suele ser suficiente la inyección de 15-20 ml y para un miembro inferior unos 30-50 ml.
5.3.2 Flebografía selectiva
Generalmente son estudios diagnósticos que conllevan una intervención terapeútica consecutiva. Suelen requerir por tanto, un acceso venoso directo central. A partir de este se cateterizaran de forma selectiva los territorios a estudiar. Entre los estudios selectivos se incluyen el estudio de venas hepáticas, renales, espermáticas u ováricas, iliocavografías y cavografías superiores.
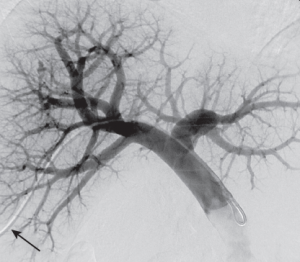
Fig.10 Venografía con substracción digital de la vena ovárica izquierdaque muestra el relleno del plexo venoso uterino (fecha) y el drenaje a través de la vena ilíaca interna ipsilateral (cabeza de flecha).
La técnica de punción mas fiable, segura y menos iatrogénica para el acceso a venas centrales, es la guiada por ecografía.
Los accesos venosos centrales mas habituales son las venas femorales comunes y las yugulares internas, priorizando el lado derecho, que presenta menor dificultad anatómica. Menos frecuentes son los accesos a través de vena poplítea, humeral o subclavia. A diferencia de la arteria en la que se obtiene la salida de sangre pulsátil, la vena necesita de la presión negativa continua que realizamos con jeringa para demostrar una adecuada posición.
5.3.3 Estudios vasculares venosos especiales
Por último existen una serie de procedimientos a los que es difícil acceder por un acceso endovascular directo, y deberemos realizar punción percutáneas, como en el caso del estudio directo del sistema porta y en las malformaciones vasculares.
El estudio portal directo se realiza tras punción percutánea sobre el hígado o el bazo. Una vez introducida la guía, se procederá de forma habitual, colocando un introductor y realizando los estudios angiográficos que se necesiten.
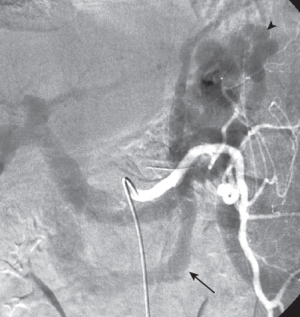
Fig.11 Angiografía con substracción digital del sistema portal.Mediante un abordaje medioaxilar se accede al sistema portal intrahepático. La cateterización de la porta con catéter de 5-French (flecha) permite la realización de la portografía. El tracto percutáneo se embolizó con Gelfoam al final del procedimiento.
Es muy importante tener en cuenta que una vez finalizado el procedimiento, es necesario embolizar el tracto que hemos realizado sobre el hígado o el bazo, para evitar complicaciones posteriores. Para ello, podremos utilizar coils o espongostan, que no plantean muchas complicaciones técnicas.
Los estudios diagnósticos en el campo de las anomalías vasculares requieren la realización de flebografías directas no selectivas en la mayoría de las ocasiones, sobre todo si se trata de malformaciones venosas (MV) ó combinadas (MVL- malformación venolinfática). El objetivos es demostrar la extensión de las mismas y estudiar de forma precisa el drenaje venoso de las mismas.
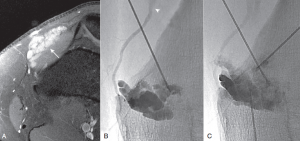
Fig.12 Malformación venosa (MV) sintomática en la pierna derecha. A. Imagen axial de RM con contraste iv. Que muestra la localización de la MV (flecha). B. Venograma tras punción directa y guía ecográfica. La inyección lenta de contraste rellena la malformación y nos muestra la vena de drenaje (cabeza de flecha). C. Dos accesos adicionales con aguja de 21G permiten la inyección de 4ml de espuma de polidocanol. El volumen de espuma introducido por cada aguja se ajusta al volumen de contraste necesario en cada inyección para replecionar la vena de drenaje.
5.4 Linfografía Y Linfangiografía Diagnóstica
La linfografía es una técnica que consiste en la visualización de los ganglios linfáticos, tras su relleno con contraste. El término de linfangiografía se debe de utilizar cuando es exploran los vasos linfáticos además de los ganglios.
Existen dos tipos básicos de linfografías:
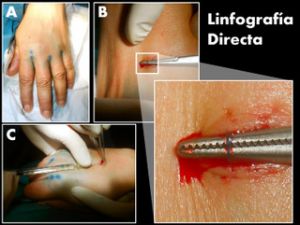
1. Linfografía directa. Consiste en disecar y canalizar un vaso linfático para la inyección directa de una contraste iodado oleoso que permite el estudio de los vasos linfáticos y cadenas ganglionares del trayecto estudiado.
Fig.13 Disección y canalización de canalítico linfático en el dorso de la mano izquierda. A. Imagen que muestra la inyección intradérmica de azul de metileno que permite colorear el canalículo biliar de mayor tamaño accesible a la disección. B. Recuadro y magnificación del canalículo disecado y controlado. C. Inyección de 0,3ml de contraste oleoso para iniciar la linfangiografía. (Fotografía cedida por cortesía del Dr. A. Alonso, Hospital universitario Fundación Jiménez Díaz)
La variante más frecuente es la linfangiografía pedia bilateral, en la que se estudian desde los vasos superficiales del antepié hasta la cisterna de Pecquet, dónde se reúnen los linfáticos intestinales (quilíferos) y continúa por el conducto torácico hasta la confluencia venosa yugulosubclavia izquierda.
2. Linfografía y Linfagiografía indirecta. Consiste en una inyección de contraste no iónico, hidrosoluble en infusión intradérmica , que permite observar los linfáticos intradérmicos, sin colectores. Su uso es muy limitado, básicamente en algunos casos de linfedema.
5.5 Bibliografía
1. Brockow K. Immediate and delayed reactions to radiocontrast media: is there an allergic mechanism? Immunol Allergy Clin North Am. 2009;29:453-468.
2. Brueck M, Bandorski D, Kramer W, et al. A randomized comparison of transradial versus transfemoral approach for coronary angiography and angioplasty. J Am Coll Cardiol Cardiovasc Interv. 2009;2:1047-1054.
3. Chan D, Downing D, Keough CE, et al. Joint practice guideline for sterile techniqueduring vascular and interventional radiology procedures. J Vasc Interv Radiol.2012;23:715-724.
4. Dariushnia SR, Wallace MJ, Siddiqi NH, et al. Quality improvement guidelines for central venous access. J Vasc Interv Radiol. 2010;21:976-981.
5. Das R, Ahmed K, Athanasiou T, Morgan RA, Belli AM. Arterial closure devices versus manual compression for femoral haemostasis in interventional
radiological procedures: a systematic review and meta-analysis. Cardiovasc
Intervent Radiol. 2011;34:723-738.
6. Hawkins IF, Cho KJ, Caridi JG. Carbon dioxide in angiography to reduce the riskof contrast-induced nephropathy. Radiol Clin North Am. 2009;47:813-825.
7. Heran MK, Marshalleck F, Temple M, et al. Joint quality improvement guidelines for pediatric arterial access and arteriography: from the Societies of Interventional Radiology and Pediatric Radiology J. Vasc Interv Radiol. 2010;21:32-43.
8. Kadir S. Diagnostic Angiography. Philadelphia: WB Saunders; 1986.
Kandarpa K, Machan L. Handbook of Interventional Radiologic Procedures. 4th ed. Philadelphia: Wolters Kluwer; 2011.
9. Kerns SR, Hawkins IF. Carbon dioxide digital subtraction angiography: expanding applications and technical evolution. Am J Roentgenol. 1995;164:735-741.
10. Kim D, Orron DE. Peripheral Vascular Imaging and Intervention. St. Louis:
Mosby-Yearbook; 1992.
11. Leiner T, Kucharczyk W. NSF prevention in clinical practice: summary of
recommendations and guidelines in the United States, Canada, and Europe. J Magn Reson Imaging. 2009;30:1357-1363.
12. Levitin A. Intravascular ultrasound. Tech Vasc Interv Radiol. 2001;4:66-74.
Miller DL, Vano E, Bartal G, et al. Occupational radiation protection in interventional radiology: a joint guideline of the Cardiovascular and Interventional Radiology Society of Europe and the Society of Interventional Radiology. J VascInterv Radiol. 2010;21:607-615.