Capítulo 15 - Isquemias Viscerales
El diagnóstico y tratamiento de la patología isquémica intestinal está a caballo entre varias especialidades ya que el tipo de síntomas iniciales, dolor abdominal y/o pérdida de peso, suele llevar a la consulta de internistas, digestivos o cirujanos generales que son los que inicialmente sospechan la existencia de esta patología pero para su tratamiento suele ser preciso el concurso del cirujano vascular. Los principales tipos de isquemias intestinales son: isquemia aguda mesentérica, isquemia mesentérica no oclusiva, trombosis venosa mesentérica es isquemia crónica mesentérica.
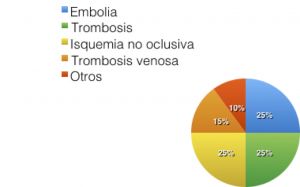
Fig.1 Distribución estadística de isquemias viscerales agudas
15.1 Anatomía
Existe una gran variabilidad anatómica en las arterias viscerales y sus ramas producto del desarrollo embrionario humano. En esta fase existen una aorta dorsal, de la que se desarrollará la aorta del adulto, y una aorta ventral conectada con la anterior por numerosas arterias segmentarias. A partir de la cuarta semana de gestación la aorta ventral y las segmentarias involucionan hasta desaparecer, salvo la 10ª, 13ª y 21ª que darán lugar respectivamente al tronco celíaco, la arteria mesentérica superior y la arteria mesentérica inferior.
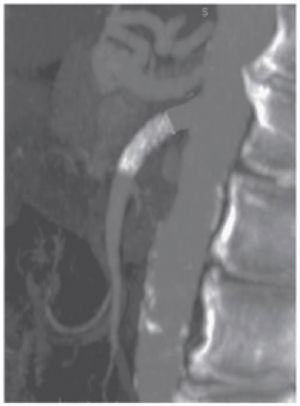
Fig. 2 AngioRNM aorta y ramas viscerales
El tronco celíaco (TC) se origina aproximadamente a nivel de D12-L1 y en su configuración mas frecuente (75%) se divide en tres ramas: gástrica izquierda, esplénica y hepática común.
La arteria mesentérica superior (AMS) se origina a nivel de L1, entre 0’2 y 2 cm por debajo de tronco celíaco y su primera rama suele ser la pancreático duodenal inferior que conecta con la pancreático duodenal superior y la gastroduodenal, ramas del tronco celíaco, con lo que se establece una importante red de colateralidad. Otra de sus ramas, la cólica media conectará con la rama ascendente de la cólica izquierda, rama de la mesentérica inferior que da lugar a otra vía colateral conocida como arteria marginal de Drummond.
La arteria mesentérica inferior (AMI) se origina a nivel de L3 y da la cólica izquierda y varias ramas sigmoideas que a su vez conectan con ramas de las arterias hipogástricas.
15.2 Fisiopatología
Las arterias esplácnicas son responsables de amplias fluctuaciones del flujo intestinal, pudiendo oscilar entre el 10 y el 35% del gasto cardiaco según el momento, especialmente por cambios en los vasos que irrigan el intestino delgado.
En estudios de flujo e imagen con eco-doppler se ha comprobado que tras la ingesta puede producirse aumentos significativos del diámetro y del flujo en la arteria mesentérica superior.
En general se cree que para desarrollar sintomatología isquémica intestinal deberían estar lesionados al menos dos de los tres troncos viscerales y que al menos una de ellas sea la arteria mesentérica superior. La lenta progresión de la aterosclerosis permite el desarrollo de circulación colateral que rara vez hace que la lesión de un solo vaso sea sintomática, salvo que la arteria afectada sea la mesentérica superior, especialmente si es una oclusión completa y brusca. En este caso el flujo colateral proporcionado desde la el TC y la AMI no impedirá una isquemia intestinal significativa. Otra rara excepción se produce en casos de una estenosis significativa del TC por compresión del ligamento arcuato y los pilares del diafragma.
Se ha comprobado en estudios angiográficos por otras causas y en necropsias que un 27% de los casos presentaban estenosis del TC o AMS >50% asintomáticos.
Fig. 3 Síndrome Leriche y estenosis AMS. Arteriografía
15.3 Clínica
15.3.1 Isquemia Arterial Mesentérica Aguda
Afecta de forma preferente, pero no exclusiva, a ancianos, a menudo con otras enfermedades concomitantes.
El cuadro se inicia con dolor abdominal vago, de aparición brusca, que se exacerba a la exploración y que, a medida que pasa el tiempo, se asocia a distensión abdominal, defensa a la palpación, leucocitosis, acidosis, hipotensión y diarrea sanguinolenta. Cuando se realiza la laparotomía exploradora nos encontramos, lamentablemente en la mayoría de los casos, ante un infarto intestinal irreversible. En esta situación pocos pacientes sobreviven a una resección intestinal y los que lo hacen padecen las graves secuelas de un síndrome de intestino corto. El diagnóstico precoz es la clave para la mejora de resultados ya que un retraso de 3 horas puede hacer irreversible este cuadro.
Las dos causas principales son la trombosis y la embolia de la arteria mesentérica superior.
La embolia de la AMS supone el 25% de los casos de isquemia mesentérica aguda, la mayoría de los émbolos tienen origen cardiaco. Hay que sospechar la isquemia mesentérica aguda por embolismo en todo paciente con dolor abdominal, vaciado intestinal (vómitos, diarrea o defecación) y fuente embolígena (IAM reciente, arritmia, valvulopatía, insuficiencia cardiaca…). Tiene mejor pronóstico que la trombosis mesentérica ya los émbolos se suelen alojar distalmente a la salida de la arteria cólica media lo que que permite cierto grado de circulación colateral.
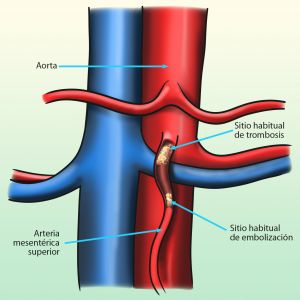
Fig. 4 Localización de émbolos en AMS
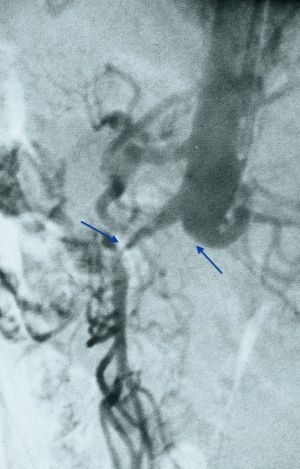
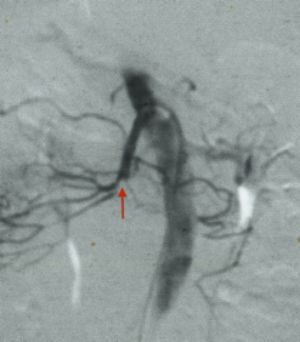
Fig. 5 Embolia en tronco de la arteria mesentérica superior. Angiografía
La trombosis de arteria mesentérica superior o sus ramas supone otro 25% de los casos. La causa puede estar en situaciones de bajo flujo o expansión brusca de una placa de ateroma que origina una estenosis severa sin posibilidad de desarrollo de compensación por colateralidad. La mayoría de los casos son mujeres, edad > 70 años y con patologías vasculares diagnosticadas en otros territorios. Solo un 20% tenían antecedentes de síntomas compatibles con isquemia intestinal crónica. La mortalidad de las isquemia mesentérica aguda es aproximadamente de un 60% con peores porcentajes en la trombosis frente a las embolias.
15.3.2 Isquemia Arterial Mesentérica Crónica
El paciente típico es una mujer (76%), entre 40 y 70 años, fumadora, caquéctica, de mediana edad, con dolor abdominal y pérdida de peso.
Clínicamente se presenta con dolor postprandial localizado en epigastrio y pérdida de peso. En un 25% de los pacientes habían vómitos y alteraciones del transito intestinal.
El dolor se suele presentar 15-30 minutos después de comer, meso-epigástrico, sordo e intenso. Dura entre 1 y 4 horas. Inicialmente se presenta solo tras comidas copiosas para, en lesiones mas severas, aparecer tras cualquier ingesta e incluso en ayunas.
La pérdida de peso es debida a que la relación comer-dolor hace que el paciente coma escasamente sin que existan problemas de mala absorción intestinal asociados. El 60% de los pacientes presenta un peso al menos 15% por debajo de su peso ideal.
A la exploración se detecta en la mayoría de los pacientes soplo abdominal como signo indirecto de enfermedad aterosclerótica local.
En un 25% de los pacientes existe úlcera péptica asociada.
La evolución natural de la enfermedad sin tratamiento es a la muerte por inanición o por infarto intestinal.
15.3.3 Isquemia Mesentérica Aguda No Oclusiva
Representa el 20-30% de las isquemias mesentéricas agudas, está causada por vasoconstricción esplácnicas primaria y tiene una mortalidad del 70%. Se asocia a la circulación extracorpórea, estados de shock y uso de medicamentos vasoactivos (digoxina, vasopresina, alfa adrenérgicos, cocaína o ergotamínicos).
Se presenta en pacientes ancianos en situación de infarto agudo de miocardio en estado de shock, insuficiencia cardiaca congestiva, arritmia, hipovolemia en pacientes quemados, septicemia, politraumatismos, pancreatitis, hemorragia y administración de fármacos vasoactivos esplácnicos.
Cursan con dolor abdominal desproporcionado en relación con la exploración. Cuando no existe dolor (25%) la distensión abdominal inexplicable y hemorragia pueden ser los primeros síntomas. También pueden aparecer fiebre, vómitos, diarrea, nauseas y disminución del peristaltismo
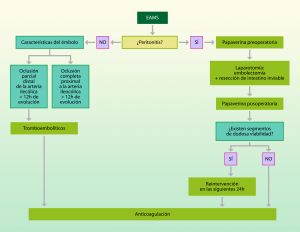
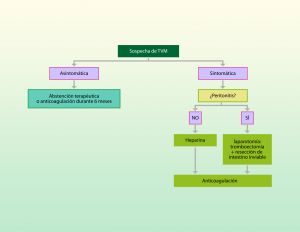
15.3.4 Trombosis Venosa Mesentérica
Es un trastorno raro (5-15%) con amplia variedad de presentaciones clínicas. Dada su presentación insidiosa y su diagnóstico tardío sigue siendo causa de frecuente morbimortalidad.
Suele afectar a las venas mesentérica superior y esplácnicas y es la causa menos frecuente de isquemia mesentérica aguda.
La presentación clínica depende de la extensión y localización del trombo. Debe sospecharse en pacientes con síntomas abdominales agudos y antecedentes de trombosis venosas y/o coagulopatías. Frecuentemente sus síntomas se limitan a anorexia y dolor abdominal inespecífico y generalizado, el dolor puntual agudo es signo ominoso de isquemia intestinal transmural. Hay diarrea en una tercera parte de los casos y en la mitad de los pacientes sangre oculta en heces. A la exploración puede haber distensión abdominal.
15.4 Diagnóstico
EL diagnóstico es casi siempre por exclusión tras descartar cualquier otra patología abdominal.
El EKG con arritmia nos puede hacer sospechar causas embolígenas en pacientes con cuadro de isquemia mesentérica aguda.
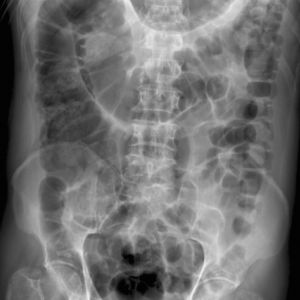
La Rx simple abdominal es normal en la isquemia crónica y en el 25% de los casos de isquemia aguda mesentérica, en el resto de los casos avanzados se puede apreciar edema de la pared intestinal o neumatosis.
Fig. 6 Rx simple abdomen. Isquemia mesentérica aguda. Distensión de asas intestinal.
Los estudios analíticos aportan escasa información para el diagnóstico precoz. La leucocitosis, la elevación de LDH o amilasa implica a menudo isquemia grave o infarto
Se está evaluando un estudio inmunoanalítico enzimático que detecta las concentraciones elevadas de proteína transportadora de ácidos grasos intestinales que se asocia a isquemia intestinal, especialmente si existe infarto.
La disponibilidad, rapidez, precisión de imagen y datos adicionales sobre las estructuras abdominales que aporta el AngioTAC está cambiando los algoritmos diagnósticos en las isquemias mesentéricas. Se debe realizar estudio en fase arterial y venosa simultáneamente.
La aortografía es la prueba diagnóstica reina ya que además de establecer el diagnóstico ofrece la posibilidad de actuaciones terapéuticas ( vasodilatadores, trombolisis, angioplastias,…) simultáneas.
El Eco-Doppleren la isquemia mesentérica agudaestá limitado por la distensión abdominal, los gases intestinales y el dolor abdominal que sufre el paciente al comprimir con el traductor, sin embargo en las isquemiasmesentéricas crónicas se identifica con precisión las estenosis significativas en TC y AMS pero es necesaria una gran experiencia en su manejo y debe ser realizado en ayunas. Cuando se detectan velocidades sistólicas > 275 cm/s en la AMS la sensibilidad es del 92% y la especificidad del 96% para estenosis >70%. Cuando se detectan velocidades sistólicas > 200 cm/s en el TC la sensibilidad es del 90% y la especificidad del 91% para estenosis >70%. Cuando la velocidad telediastólica es > 45 cm/s en AMS hay una sensibilidad del 90% y especificad del 91% para estenosis >50%. Cuando la velocidad telediastólica es > 55 cm/s en el TC hay una sensibilidad del 93% y especificad del 100% para estenosis >50%.
La RNM tiene las ventajas de ser altamente sensible y específica para estenosis >75%, no es nefrotóxica y evita el riesgo de reacciones alérgicas a contrastes yodados. La desventaja de AngioRNM es la escasa resolución, especialmente de las ramas distales o en estados de bajo flujo. El error mas frecuente es sobrestimar la estenosis.
15.5 Tratamiento
15.5.1 Isquemia Arterial Mesentérica Aguda
De forma inmediata hay que reponer líquidos y electrolitos, administrar HBPM para evitar la propagación del trombo y administrar antibióticos de amplio espectro porque la flora bacteriana intestinal atraviesa la pared con la isquemia. Después se debe proceder a la cirugía de forma inmediata.
Si es factible se debe intentar tratamiento con trombolisis local y anticoagulación sistémica y,
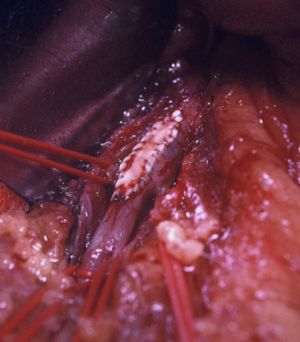
Fig. 7 Cierre con parche de AMS tras embolectomía
si posteriormente los precisa, con angioplastia
producir hemorragias digestiva y perforación intestinal.
El tratamiento quirúrgico abierto se realiza a través de una laparotomía que permita en primera instancia comprobar la viabilidad del intestino, seguido de revascularización de la AMS y posterior resección o no de segmentos de intestino. La embolectomía y la derivación arterial (by-pass) de la mesentérica superior son las alternativas disponibles.
15.5.2 Isquemia Arterial Mesentérica Crónica
Todos los pacientes con síntomas de isquemia mesentérica crónica deben someterse a revascularización. Los objetivos son: reducir el dolor, evitar el infarto intestinal y permitirles recuperar un estado nutricional normal. No hay consenso sobre los pacientes asintomáticos aunque se recomienda revascularizar la AMS solo si se precisa una intervención concomitante por aneurisma de aorta o enfermedad atómica oclusiva.
Actualmente no existe evidencia ni consenso sobre el tipo de revascularización (cirugía endovascular o cirugía abierta). Los tratamientos endovasculares son menos invasivos, tienen menor morbimortalidad, exigen menos ingreso hospitalario y tienen menos coste, sin embargo sus resultados a medio y largo plazo son peores que la cirugía abierta dadas las características de las lesiones.
Las técnicas endovasculares son la angioplastia simple, el stent y la endoprótesis.
>Fig. 8 Stent en AMS
Entre las cirugías abiertas están la endarterectomía y el by-pass.
Fig. 9Bypass ilíaco-mesentérico superior
Actualmente se recomienda la revascularización de un solo vaso (arteria mesentérica superior). La mortalidad quirúrgica en pacientes programados es del3% y las oclusiones perioperatorias del injerto del 6%.
15.5.3 Trombosis venosa Mesentérica
El tratamiento varía desde la observación estrecha del paciente y reposo intestinal, con o sin anticoagulación, hasta la resección intestinal con trombectomía venosa.
Inicialmente es recomendable el tratamiento conservador con reposo intestinal y anticoagulación a dosis plenas. Igualmente debe hacerse cribado completo de factores de trombofilia.
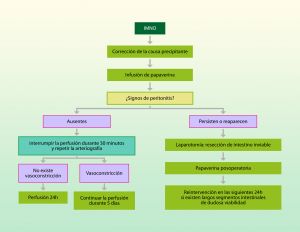
15.5.4 Isquemia Mesentérica No Oclusiva
El tratamiento expeditivo de los factores predisponentes (complicaciones cardiacas, estados de shock) es fundamental junto con la estabilización hemodinámica rápida. Deben evitarse los vasocronstrictores sistémicos.
El tratamiento con perfusión intrarterial en la AMS de papaverina puede ser un tratamiento eficaz y rápido para combatir el vasospasmo esplácnico. La anticoagulación sistémica no se precisa.
Si se sospecha isquemia transmural o perforación hay que realizar una laparotomía y valorar resección intestinal.
15.6 Bibliografía
1. Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
2. Rutherford´s Vascular Surgery. 8Th Edition. Rutherford. Jack L. Cronenwett MD, K. Wayne Jhonston. Elservier Saunders 2014.Michal Tendera (Chairperson)* (Poland),Victor Aboyans (Co-Chairperson)* (France), Marie-Louise Bartelink (TheNetherlands), Iris Baumgartner (Switzerland), Denis Cle´ment (Belgium),Jean-Philippe Collet (France), Alberto Cremonesi (Italy), Marco De Carlo (Italy),Raimund Erbel (Germany), F. Gerry R. Fowkes (UK), Magda Heras (Spain),Serge Kownator (France), Erich Minar (Austria), Jan Ostergren (Sweden),Don Poldermans (The Netherlands), Vincent Riambau (Spain), Marco Roffi(Switzerland), Joachim Ro¨ ther† (Germany), Horst Sievert (Germany), Marc van Sambeek (The Netherlands), Thomas Zeller (Germany). 06, 2001. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases. European Heart Journal 32, 2851-2906 2011.
3. Thomas JH, Blake K, Pierce GE, Hermreck AS, Seigel E. The clinical course of asymptomatic mesenteric arterial stenosis. J Vasc Surg 1998;27:840–844.
4. Van Bockel JH, Geelkerken RH, Wasser MN. Chronic splanchnic ischaemia. Best Pract Res Clin Gastroenterol 2001;15:99–119.
5. Taylor LM Jr, Moneta GL. Intestinal ischemia. Ann Vasc Surg 1991;5:403–406.
6. Ghosh S, Roberts N, Firmin RK, Jameson J, Spyt TJ. Risk factors for intestinal ischaemia in cardiac surgical patients. Eur J Cardiothorac Surg 2002;21:411–416.
7. Wilson DB, Mostafavi K, Craven TE, Ayerdi J, Edwards MS, Hansen KJ. Clinical course of mesenteric artery stenosis in elderly Americans. Arch Intern Med 2006;166:2095–2100.
8. Mensink PB, van Petersen AS, Geelkerken RH, Otte JA, Huisman AB, Kolkman JJ. Clinical significance of splanchnic artery stenosis. Br J Surg 2006;93:1377–1382.
9. Pellerito JS, Revzin MV, Tsang JC, Greben CR, Naidich JB. Doppler sonographic criteria for the diagnosis of inferior mesenteric artery stenosis. J Ultrasound Med 2009;28:641–650.
10. Armstrong PA. Visceral duplex scanning: evaluation before and after artery intervention for chronic mesenteric ischemia. Perspect Vasc Surg Endovasc Ther 2007;19:386–392; discussion 393–384.
11. Dietrich CF, Jedrzejczyk M, Ignee A. Sonographic assessment of splanchnic
12. arteries and the bowel wall. Eur J Radiol 2007;64:202–212
13. Cademartiri F, Palumbo A, Maffei E, Martini C, Malago R, Belgrano M, La Grutta L, Bartolotta TV, Luccichenti G, Midiri M, Raaijmakers R, Mollet N, Zompatori M, Crisi G. Noninvasive evaluation of the celiac trunk and superior mesenteric artery with multislice CT in patients with chronic mesenteric ischaemia. Radiol Med 2008;113:1135–1142.
14. Horton KM, Fishman EK. Multidetector CT angiography in the diagnosis of mesenteric ischemia. Radiol Clin North Am 2007;45:275–288.
15. Hellinger JC. Evaluating mesenteric ischemia with multidetector-row CT angiography. Tech Vasc Interv Radiol 2004;7:160–166.
16. Laghi A, Iannaccone R, Catalano C, Passariello R. Multislice spiral computed tomography angiography of mesenteric arteries. Lancet 2001;358:638–639.
17. Otte JA, Huisman AB, Geelkerken RH, Kolkman JJ. Jejunal tonometry for the diagnosis of gastrointestinal ischemia. Feasibility, normal values and comparison of jejunal with gastric tonometry exercise testing. Eur J Gastroenterol Hepatol 2008;20:62–67.
18. Cleveland TJ, Nawaz S, Gaines PA. Mesenteric arterial ischaemia: diagnosis and therapeutic options. Vasc Med 2002;7:311–321.
19. Cognet F, Ben Salem D, Dranssart M, Cercueil JP, Weiller M, Tatou E, Boyer L, Krause D. Chronic mesenteric ischemia: imaging and percutaneous treatment. Radiographics 2002;22:863–879; discussion 879–880.
20. Laissy JP, Trillaud H, Douek P. MR angiography: noninvasive vascular imaging of the abdomen. Abdom Imaging 2002;27:488–506.
21. Schermerhorn ML, Giles KA, Hamdan AD, Wyers MC, Pomposelli FB. Mesenteric revascularization: management and outcomes in the United States,1988–2006. J Vasc Surg 2009;50:341–348.
22. Davies RS, Wall ML, Silverman SH, Simms MH, Vohra RK, Bradbury AW, Adam DJ. Surgical versus endovascular reconstruction for chronic mesenteric ischemia: a contemporary UK series. Vasc Endovascular Surg 2009;43:157–164.
23. Lee RW, Bakken AM, Palchik E, Saad WE, Davies MG. Long-term outcomes of endoluminal therapy for chronic atherosclerotic occlusive mesenteric disease. Ann Vasc Surg 2008;22:541–546.
24. Zerbib P, Lebuffe G, Sergent-Baudson G, Chamatan A, Massouille D, Lions C, Chambon JP. Endovascular versus open revascularization for chronic mesenteric ischemia: a comparative study. Langenbecks Arch Surg 2008;393:865–870.
25. AbuRahma AF, Stone PA, Bates MC, Welch CA. Angioplasty/stenting of the superior mesenteric artery and celiac trunk: early and late outcomes. J Endovasc Ther 2003;10:1046–1053.
26. Zeller T, Rastan A, Schwarzwalder U, Schwarz T, Frank U, Burgelin K, Sixt S, Muller C, Rothenpieler U, Flugel PC, Neumann FJ. Endovascular therapy of chronic mesenteric ischaemia. EuroIntervention 2007;2:444–451.
27. Schaefer PJ, Schaefer FK, Hinrichsen H, Jahnke T, Charalambous N, Heller M, Mueller-Huelsbeck S. Stent placement with the monorail technique for treatment of mesenteric artery stenosis. J Vasc Interv Radiol 2006;17:637–643.
28. Mell MW, Acher CW, Hoch JR, Tefera G, Turnipseed WD. Outcomes after endarterectomy for chronic mesenteric ischemia. J Vasc Surg 2008;48:1132–1138.
29. Biebl M, Oldenburg WA, Paz-Fumagalli R, McKinney JM, Hakaim AG. Surgical and interventional visceral revascularization for the treatment of chronic mesenteric ischemia—when to prefer which? World J Surg 2007;31:562–568.