Capítulo 12 - Síndrome Aórtico Agudo
12.1 Definición
El síndrome aórtico agudo (SAA) es un proceso brusco de la pared aórtica que cursa con debilitamiento de la capa media, lo que conlleva el riesgo de rotura aórtica y otras complicaciones. Estáconstituido por cinco entidades: la disección aórtica, el hematoma intramural, la úlcera penetrante, el aneurisma rápidamente expansivo y el traumatismo aórtico. Estos dos últimos se tratarán en los capítulos de Aneurismas y Traumatismos Vasculares.
12.2 Epidemiología
Entre el 1%y 3% de las autopsias se identifica una disección aórtica. Los afroamericanos, los hombres, los ancianos y las personas con hipertensión arterial presentan un riesgo más elevado.
La incidencia máxima se identifica entre los 50 y los 65 años o, en los individuos con enfermedades congénitas del tejido conectivo (síndrome de Marfan, síndrome de Ehlers-Danlos), entre los 20 y los 40 años.
En España el SAA afecta entre 20-40 casos/millón de habitantes/año (varones-mujeres 70%-30%). Del total el 80% son disecciones, 15% son hemorragias intramurales y 5% úlceras penetrantes. El 68% se presenta en aorta ascendente y el 32% en aorta descendente.
La mortalidad inmediata de la disección aórtica es del 40% ( no llegan al hospital). La mortalidad hospitalaria es del 35,4% ( 26-41% tipo A y 15-23% tipo B )
Los tipos A no operados tienen un mortalidad del 71% y los operados del de 33%.
Los tipos B que se operan con cirugía abierta tienen una mortalidad del 50%, si es con tratamiento endovascular un 27% y si solo precisan tratamiento médico un 17% de mortalidad.
12.3 Clasificación
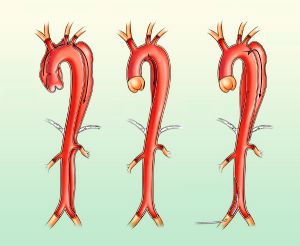
Las disecciones aórticas se clasifican según criterios anatómicos. Los sistemas de clasificación de DeBakey y de Stanford son los empleados con mayor asiduidad.
Tipo I (50% de las disecciones): comienzan en la aorta ascendente y se extienden al menos hasta el arco aórtico y, a veces, hasta regiones más distales.
Tipo II (35%): comienzan en la aorta ascendente y quedan limitadas a esta porción.
Tipo III (15%): comienzan en la porción torácica de la aorta descendente justo distal al origen de la arteria subclavia izquierda y se extienden en dirección distal o, con menor frecuencia, en dirección proximal.
Fig. 1 Sistema de clasificación de DeBakey
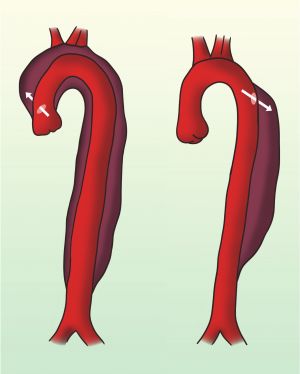
Tipo A: estas disecciones comprometen la aorta ascendente.
Tipo B: estas disecciones quedan limitadas a la porción descendente de la aortatorácica.
A B
Fig. 2 Sistema de clasificación de Stanford
Si bien la disección puede originarse en cualquier sitio a lo largo de la aorta, su localización más frecuente es la porción proximal de la aorta ascendente (a menos de 5 cm de la válvula aórtica) o la aorta torácica descendente (justo distal al origen de la arteria subclavia izquierda). Rara vez la disección queda limitada a arterias individuales (arterias coronarias o carotídeas), típicamente en mujeres embarazadas o puérperas.
12.4 Etiología
La disección aórtica siempre se produce en un paciente con degeneración preexistente de la capa media de la aorta (degeneración de la media): elastina, colágeno y células musculares lisas. Los factores de riesgo que favorecen estas lesiones abarcan trastornos adquiridos, enfermedades del tejido conectivo, iatrogenias y traumatismos.
Trastornos adquiridos:Lahipertensión arterial, presente en mas de 2/3 de los pacientes, es el factor de riesgo mas modificable. Produce engrosamiento intimal, muerte de células musculares lisas, fibrosis, pérdida de elasticidad y alteración de la vascularización de la pared aórtica, que junto a la presión de cizallamiento a la que estásometida la aorta predisponen a la disección. Además influyen el tabaquismo, dislipemias o consumo reciente de cocaína. Estos últimos factores son más prevalentes en los SAA tipo B.
Enfermedades del tejido conectivo hereditarias que alteren la estructura de la aorta:Necrosis quística de la media, Síndrome de Ehlers-Danlos, Síndrome de Marfan, Síndrome de Turner,aneurisma de la aorta torácica familiar, enfermedad valvular aórtica bicúspide, arteria subclavia derecha anómala, coartación aórtica, síndrome de Noonan, riñón poliquístico y síndrome de Loeys-Dietz.
La mitad de los pacientes que sufren disección aórtica antes de los 40 años tiene síndrome de Marfan. Las mutaciones del gen codifican fibrilina 1 (FBN1), un componente esencial de las microfibrillas que ayudan a formar adhesiones celulares en la matriz extracelular, son en gran medida responsables de la expresión de esta enfermedad.
En el síndrome de Ehlers-Danlos tipo IV la aorta se encuentra afectada debido a un trastorno autosómico dominante atribuido a defectos estructurales en el colágeno III, codificado por el gen COL3A1 en el cromosoma 2q31.
La enfermedad aneurismática de aorta torácica familiar presenta alteraciones en los locus 16p13.11 (gen MYH11), 5q13-14 y 11q23.2-q24, que no están asociados a anomalías de la fibrilina o el colágeno.
La enfermedad de la válvula aórtica bicúspide es la cardiopatía congénita mas frecuente en los adultos y suele asociarse a una histopatología parecida al síndrome de Marfan, pero mas leve , como también ocurre en el síndrome de Turner, coartación aórtica, síndrome de Noonan y riñón poliquístico.
Enfermedades del tejido conectivo adquiridas: En el síndrome de Behçet, Arteritis de células gigantes, Arteritis de Takayasu, Lupus eritematoso sistémico, Policondritis recurrente y en aortitis en el seno de Enfermedad inflamatoria intestinal, se pueden destruir proteínas de la matriz extracelular y células musculares lisas con el posterior desarrollo de aneurismas y/o disección.
Iatrogénico: Cateterismo aórtico.Cirugía en la válvula aórtica. Representa el 5% del total de causas de disección aórtica. En muchos casos son asintomáticas.
Traumatismo: Lesiones por desaceleración. Las disecciones aórticas ( ver capítulo Traumatismos vasculares ).
Otros: La mitad de las disecciones aparecidas en mujeres menores de 40 años ocurren durante la dilatación, parto o post parto inmediato. Tanto el estrógeno como la relaxina pueden asociarse a alteraciones en la homeostasis de la metaloproteinasa (MMT). En mujeres con síndrome de Marfan y válvula aórtica bicúspide con un diámetro de la raíz de aorta >4 cm, el embarazo estácontraindicado por alto riesgo de disección. El consumo de cocaína, sobre todo en hombres jóvenes y fumadores, asícomo el consumo crónico de anfetaminas aumenta la posibilidad de sufrir disecciones toracoabdominales en el grupo de edad entre 18 y 49 años. El mecanismo parece estar medido por una disfunción endotelial secundaria a aumento del estrés oxidativo y aumento de de las fuerzas de cizallamiento secundarias a la liberación de catecolaminas, hipertensión brusca y taquicardia.
12.5 FISIOPATOLOGÍA
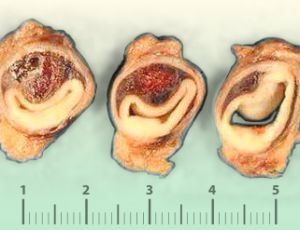
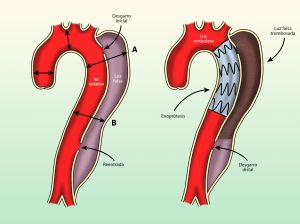
La disección de la aorta se produce por el desgarro circular o, con menor frecuencia, transversal de la íntima y parte de la capa media [Los sitios más frecuentes son a nivel de la pared lateral derecha de aorta ascendente ( es la zona que soporta mayor presión de cizallamiento de la aorta ) y del ligamento arterioso]. Después de la lesión inicial, o desgarro íntimo-medial, la presión de la sangre diseca la capa media y crea un falso canal que se extiende en dirección distal o, con menor asiduidad, en dirección proximal a lo largo de la arteria. La luz verdadera suele ser más pequeña y tiene un patrón de flujo laminar sistólico. La luz falsa suele ser mayor , su pared externa tiene menor espesor que la pared de la luz verdadera y presenta un patrón de flujo circulante lento y turbulento. Se puede producir una trombosis parcial o total de la luz falsa, pero excepcionalmente esto ocurre en la fase temprana y son casos en los que la falsa luz es más pequeña que la luz verdadera. Cuando la trombosis se produce en la fase tardía o crónica de la disección sigue siendo de mayor diámetro que la luz verdadera.
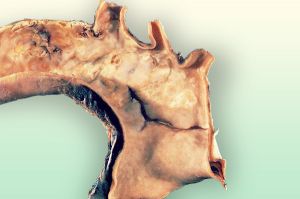
Fig. 3Piezas de necropsia de una disección aórtica 1
Fig. 4 Piezas de necropsia de una disección aórtica 2
Las disecciones pueden comunicarse con la luz aórtica verdadera si se rompe la íntima en un sitio distal, lo que permite mantener el flujo sanguíneo sistémico. No obstante las consecuencias graves son frecuentes:
D. Compromiso de la irrigación sanguínea de las arterias tributarias (incluso de las arterias coronarias).
I. Dilatación e insuficiencia de la válvula aórtica.
• Insuficiencia cardíaca.
• Rotura mortal de la aorta a través de la adventicia hacia el pericardio, la aurícula derecha o el espacio pleural izquierdo.
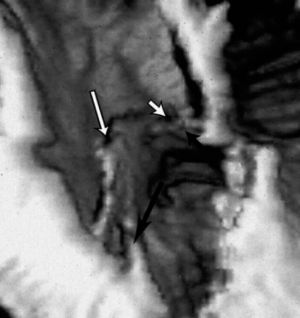
Fig. 5 Flap inicial en una disección
Las disecciones agudas (aquellas que tiene una sintomatología< 2 semanas) tienen más probabilidades de provocar estas complicaciones. El riesgo disminuye ≥2 semanas después (crónicas) de la disección, especialmente aquellas en las que la evidencia sugiere una trombosis de la falsa luz y ausencia de comunicación entre la luz verdadera y la falsa.
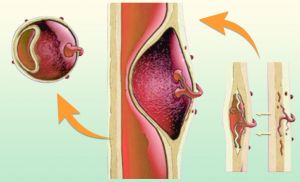
El hematoma intraparietal, generalmente en el interior de la capa media, y contenido por la propia pared aórtica. Se trata de una disección sin puerta de entrada. La mayoría de los autores atribuyen la formación del hematoma a una rotura de los vasa vasorum que desde la adventicia irrigan la pared aórtica.
Fig. 6 Esquema teórico de formación de los hematoma intramurales
La progresión de la lesión puede implicar: progresión del hematoma, regresión parcial del hematoma, disección clásica y rotura aórtica.
Si la lesión no progresa la evolución natural con el tiempo es : reabsorción del edema, aumento de macrófagos, linfocitos y polimorfonucleares para que finalmente los fibroblastos dejen una cicatriz de tejido colágeno.
La úlcera penetrante aórtica es aquella placa aterosclerótica que tras erosión y ulceración inicial rompe la lámina elástica interna y penetra en la capa media.
La localización más frecuente es en la aorta torácica descendente seguida por la aorta abdominal y pueden ser únicas o múltiples. El cráter de estas úlceras puede contener material necrótico, cristales de colesterol, trombos,…que pueden embolizar distalmente.
La evolución natural es la dilatación progresiva de la aorta y la formación de aneurismas, a veces, la destrucción de la capa media puede dar lugar a seudoaneurismas ( saculares ). Es raro que lleguen a perforarse completamente y a veces son origen de una disección.
Fig. 7 Diferentes localizaciones de úlcera penetrante en AngioTAC
12.6 Clínica
El dolor precordial o interescapular intenso típico, que a menudo se describe como lacerante o desgarrante, se manifiesta en forma súbita. El dolor suele migrar de su localización original a medida que la disección se extiende a lo largo de la aorta. Estápresente en el 90% de los pacientes.
La insuficiencia valvular aórtica aguda se presenta en el 50% de los casos de las disecciones tipo A y cursaría con pulsos saltones, aumento de la presión diferencial, soplo sistólico irradiado a borde esternal derecho y signos de insuficiencia cardiaca congestiva.
Hasta el 20% de los pacientes se diagnostica debido a un síncope provocado por el dolor intenso, la activación de los baroreceptores aórticos, la obstrucción de la porción extracraneal de la arterias cerebrales, la rotura de la aorta o un taponamiento cardíaco.
En ocasiones, los pacientes presentan síntomas de accidente cerebrovascular, infarto de miocardio, infarto intestinal, paraparesia o paraplejía, provocada por la interrupción del flujo sanguíneo a la médula espinal, mientras que la oclusión de una arteria del miembro puede producir signos de isquemia o neuropatía periférica.
La pérdida de sangre o líquido inflamatorio seroso hacia el espacio pleural izquierdo puede producir signos de derrame pleural.
La oclusión de la arteria renal puede provocar oliguria o anuria.
Además, las manifestaciones clínicas pueden deberse a compresión de estructuras adyacentes a la aorta ( vena cava superior, ganglios cervicales, bronquios o esófago ) y comprenden el síndrome de Horner, síndrome de la vena cava superior, disfonía, disfagia y afectación de las vías respiratorias.
12.7 Exploración
Ante todo el paciente impresiona de gravedad. Se encuentran inquietos y mas de 2/3 de los pacientes con disección tipo B y un tercio de los de tipo A se encuentran hipertensos.
Alrededor del 20% de los pacientes presenta una pérdida parcial o completa de los pulsos arteriales principales, que pueden aumentar y disminuir en las horas siguientes. La tensión arterial de los miembros puede diferir, a veces > 30 mm Hg, y este hallazgo sugiere un pronóstico desfavorable.
En alrededor del 50% de los pacientes con disección proximal, se ausculta un soplo de insuficiencia aórtica. También puede haber signos periféricos. Rara vez, los pacientes con insuficiencia aórtica aguda grave presentan insuficiencia cardíaca.
El taponamiento cardíaco puede producir pulso paradójico y distensión de la vena yugular.
Si en la auscultación se aprecian disminución de los tonos cardiacos y a la percusión torácica notamos matidez se debe sospechar derrame pleural.
12.8 Pruebas Diagnósticas
12.8.1 Electrocardiograma
Un EKG sin signos de isquemia miocárdica puede servir de diagnóstico diferencial entre la disección y el infarto agudo de miocardio.
12.8.2 Rx Tórax
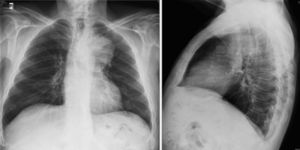
En las disecciones que afectan a aorta ascendente se muestra un ensanchamiento del mediastino superior, en general con una prominencia localizada que indica el sitio de origen. También puede haber derrame pleural izquierdo.
Fig. 8 Rx simple de Tórax con ensanchamiento mediastínico y desviación traquea
En las disecciones que afectan a aorta descendente también se suele apreciar un ensanchamiento mediastínico.
Si la radiografía de tórax sugiere una disección, debe realizarse una ecocardiografía transesofágica, un angioTAC o una angioRNM de forma inmediata una vez estabilizado el paciente. El hallazgo de un colgajo de íntima y una luz doble confirma la disección.
12.8.3 Ecocardiografia transesofágica
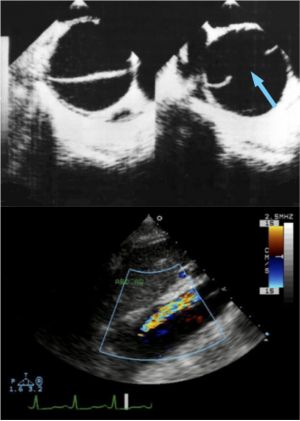
La ecocardiografía multiplanar tiene una sensibilidad de entre 97 y 99% y, con el modo M, una especificidad cercana al 100%. Puede realizarse en la cama del paciente en < 20 minutos y no requiere medios La ecocardiografía también debe solicitarse para definir la existencia de insuficiencia aórtica y, en consecuencia, para determinar si la válvula aórtica debe repararse o reemplazarse en forma concomitante.
Fig. 9 ETE. Cortes transversal y longitudinal en una disección aórtica
12.8.4 AngioTAC
Si no es posible efectuar una ecocardiografía transesofágica, se recomienda una angioTAC, que tiene un valor predictivo positivo del 100% y uno negativo del 86%.
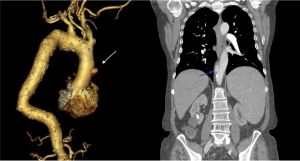
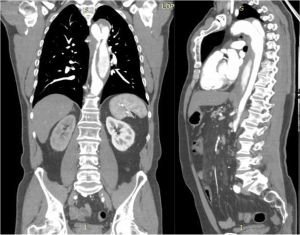
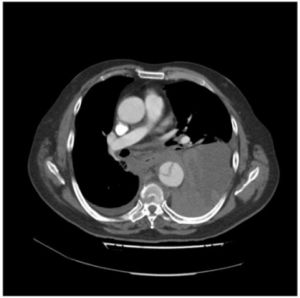
Fig. 10 AngioTAC. Disección tipo B. Corte transversal
Fig. 11 AngioTAC. Disección tipo B
12.8.5 AngioRNM
La angioRNM tiene una sensibilidad y una especificidad de casi 100% para identificar la disección aórtica, pero requiere mucho tiempo y no resulta adecuada en situaciones de emergencia. Es probable que su aplicación sea óptima en pacientes estables con dolor torácico subagudo o crónico en los que se sospecha una disección.
12.8.6 Aortografía
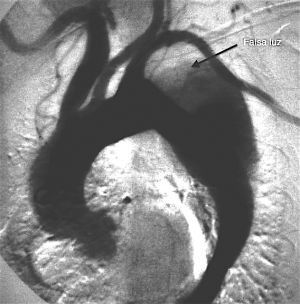
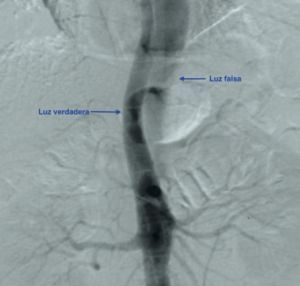
La aortografía con contraste es una opción si se estáconsiderando la cirugía. Además de identificar el origen y la extensión de la disección, la gravedad de la insuficiencia aórtica y la magnitud del compromiso de las ramas principales de la aorta, la aortografía contribuye a determinar si se requiere una cirugía de revascularización miocárdica con derivación coronaria simultánea.
Fig. 12 Disección tipo B. Ateriografía
Fig. 13 Disección a nivel de Ao abdominal
Fig. 14 Placa ulcerada en Ao torácica
12.8.7 Biomarcadores
En los últimos años se están investigando diversos biomarcadores que pueden facilitar el diagnóstico del SAA. El dímero D ha demostrado su utilidad en el diagnóstico del SAA, especialmente después de las primeras 6 h. Una de sus principales limitaciones es que no permite realizar el diagnóstico diferencial con el tromboembolismo pulmonar. Los marcadores de las cadenas pesadas de la miosina tienen alta sensibilidad y especificidad en las primeras 6 h, pero disminuyen su utilidad a las 12 h del inicio de los síntomas. La investigación del comportamiento de estos y otros nuevos biomarcadores, como la homocisteína o las metaloproteinasas, puede modificar la estrategia diagnóstica de los SAA en los próximos años y ser de gran ayuda para realizar el diagnóstico diferencial entre los síndromes que se acompañan de dolor torácico, como el síndrome coronario agudo y el tromboembolismo pulmonar.
Están en estudio otros posibles biomarcadores como la Proteína C Reactiva de alta sensibilidad, la calponina y la concentración de factor soluble de la elastina.
12.9 Diagnóstico Diferencial
Hay que realizarlo tanto entre los diferentes componentes de SAA (síndrome aórtico agudo) como con enfermedades no aórticas. Entre estos últimos hay que mencionar el tromboembolismo pulmonar (TEP), infarto agudo de miocardio (IAM), angor inestable, pericarditis, trastornos músculo esqueléticos, neumonía, pleuritis y colecistitis.
12.10 Pronóstico
Alrededor del 20% de los pacientes con disección aórtica mueren antes de llegar al hospital.
Sin tratamiento, la tasa de mortalidad oscila entre 1 y 3%/ hora durante las primeras 24 horas, alcanza el 30% a la semana y es del 80% a las 2 semanas, con un 90% al año.
La tasa de mortalidad intrahospitalaria de los pacientes tratados oscila entre el 6 y 30% en individuos con disección tipo A y del 15% en los que tienen disección tipo B.
Los pacientes tratados que sobreviven al episodio agudo presentan una tasa de supervivencia de alrededor de 60% al año y 50% a los 2 años, un tercio de los supervivientes presentan rotura, progresión de la
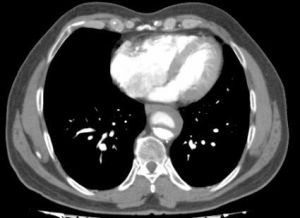
Fig. 16 AngioTAC. Disección tipo B roto
disección o precisan de una nueva intervención en los 5 primeros años. Alrededor del 33% de las muertes tardías son secundarios a complicaciones de la disección y el resto, a otros trastornos.
El hematoma intramural se diagnóstica en el 20% de los pacientes con SAA, tiene una evolución muy variable y puede reabsorberse en unos días (10%), convertirse en una disección localizada o acabar en rotura. La mortalidad se asocia a su localización y tiene peor pronóstico en la aorta ascendente o cuando tiene un espesor >11 mm. Su tratamiento sigue los mismos principios de la disección aórtica: intervención en los tipo A, seguimiento con pruebas de imagen e intervención solo si se presentan complicaciones en los tipo B.
La úlcera penetrante sintomática tiene el mismo riesgo o mayor de rotura que la disección y el hematoma intramural. Se localiza con mayor frecuencia en aorta ascendente y en algunos casos puede evolucionar hacia aneurismas saculares o fusiformes. Son signos de peor pronóstico un diámetro >2 cm y una profundidad >1 cm. Su tratamiento es inicialmente farmacológico y seguimiento y solo estáindicada la intervención (endoprótesis preferentemente) en caso de complicaciones.
12.11 Tratamiento
12.11.1 Farmacológico
Los pacientes que se diagnostican de disección aórtica deben internarse en una Unidad de Cuidados Intensivos (UCI) con monitorización intrarterial de la tensión arterial y sonda uretral permeable para controlar la diuresis.
Los pacientes con parámetros hemodinámicos inestables deben intubarse.
Debe iniciarse inmediatamente la administración de fármacos para reducir la tensión arterial, la tensión por cizallamiento de las arterias, la contractilidad ventricular y el dolor con el fin de conservar una tensión arterial ≤110 mm Hg o la mínima presión que permita mantener la perfusión cerebral, coronaria y renal adecuada.
En general, el fármaco de elección es un betabloqueante adrenérgico y el objetivo es mantener una TA 110 mmHg y una frecuencia cardiaca de 60 lpm.
Las opciones abarcan:
Metoprolol 5 mg por vía intravenosa hasta 4 dosis separadas por 15 minutos.
Esmenolol entre 50 y 200 μg/kg/minuto de infusión intravenosa continua.
Labetalol (un bloqueante α-adrenérgico y β-adrenérgico) a 2 mg/minuto de en infusión intravenosa continua o 5 a 20 mg en un bolo intravenoso inicial con dosis adicionales de 20 a 40 mg cada 10 a 20 minutos hasta lograr controlar la tensión arterial o alcanzar una dosis total de 300 mg, seguidos por dosis adicionales de 20 a 40 mg cada 4 a 8 horas según se considere necesario.
Las alternativas a los betabloqueantes son los bloqueantes de los canales de calcio (p. ej., 0,05 a 0,1 mg/kg de verapamilo en bolo intravenoso o 0,25 mg/kg de diltiazem [hasta 25 mg] en bolo intravenoso o en infusión continua a 5 o 10 mg/hora).
Si la tensión arterial sistólica permanece > 110 mm Hg a pesar de la administración de betabloqueantes, puede iniciarse una infusión intravenosa continua de Nitroprusiato Na a una velocidad de 0,2 a 0,3 μg/kg/minuto, con ascenso de las dosis (a menudo hasta 200 a 300 μg/minuto) según sea necesario para controlar la tensión arterial.
No debe administrarse nitroprusiato sin un betabloqueante o un bloqueante de los canales de calcio asociado porque la activación simpática refleja secundaria a la vasodilatación puede aumentar el inotropismo ventricular y la tensión de cizallamiento aórtico, que empeora la disección.
La analgesia asociada es fundamental para aliviar el dolor e indirectamente disminuir la TA y la frecuencia cardiaca.
12.11.2 Quirúrgico
En general, debe indicarse cirugía urgente si la disección compromete la porción proximal de la aorta ( Tipo A ) y también en pacientes con isquemia de los miembros o visceral, hipertensión arterial poco controlada, dilatación aórtica persistente, extensión de la disección y evidencias de rotura aórtica, independientemente del tipo de disección aórtica. La operación también puede ser muy beneficiosa en pacientes con síndrome de Marfan y disecciones distales agudas.
En las disecciones tipo A el objetivo de la cirugía es evitar la muerte por rotura de la aorta y la insuficiencia aórtica significativa.Consiste en cerrar el orificio de entrada en la falsa luz y reconstituir la aorta con un injerto sintético. En caso de identificar insuficiencia aórtica significativa, debe tratarse con resuspensión de las valvas aórticas o reemplazo de la válvula. En algunos casos puede ser necesario reimplantar el origen de los troncos supraaórticos.
El resultado de la operación mejora con la intervención temprana y agresiva, con tasas de mortalidad que oscilan entre 7 y 36%. La morbimortalidad perioperatoria se relaciona con IAM, paraplejia, insuficiencia renal, taponamiento cardiaco hemorragias y septicemia.
Los factores que predicen una evolución desfavorable son la hipotensión arterial, la insuficiencia renal, la edad > 70 años, el dolor torácico de comienzo abrupto, la deficiencia del pulso y el supradesnivel del segmento ST en el ECG.
12.11.3 Endovascular
Las endoprótesis vasculares que sellan el orificio de ingreso en la falsa luz y aumentan la permeabilidad de la luz verdadera, la fenestración con balón (que consiste en la creación de un orificio en el colgajo de disección que separa la luz verdadera de la falsa) o ambos métodos pueden representar alternativas menos invasivas para los pacientes con disección tipo B si se desarrollan complicaciones isquémicas periféricas.
El tratamiento de disecciones tipo B mediante endoprótesis parece influir favorablemente en la evolución a largo plazo ya que no solo evita la rotura sino que remodela la aorta y evita la posterior dilatación aneurismática. Se asocia a una mortalidad < 10% y paraplejia < 3%.
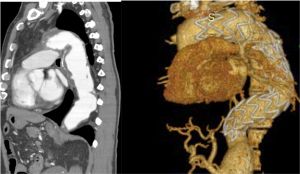
Fig. 17 Tratamiento con endoprótesis de la disección tipo B
Fig. 18 Estudio angioTAC pre y post implante de una endopótesis
El tratamiento del hematoma intramural es bastante superponible al de la disección aórtica. En el hematoma de aorta ascendente, el tratamiento es quirúrgico, aunque si no hay complicaciones, como persistencia del dolor, sangrado periaórtico o úlcera aórtica, puede operarse en las mejores condiciones quirúrgicas en las primeras 24-72 h. En los pacientes mayores de 75 años o con comorbilidad podría plantearse el seguimiento próximo con técnicas de imagen hasta evidenciar la reabsorción del hematoma. En los hematomas de aorta descendente, el tratamiento de elección es el médico. La evolución con disección localizada que condiciona imágenes de úlcera-like no es por símisma una indicación de tratamiento quirúrgico o endovascular. Por el contrario, la presencia de una dilatación brusca importante con signos de rotura inminente y sangrado periaórtico en un paciente con persistencia del dolor obliga a plantear el tratamiento endovascular. Este tratamiento puede realizarse con buenos resultados cuando los extremos de la endoprótesis se implantan sobre la pared aórtica sana y no sobre el hematoma, ya que podría favorecer la rotura intimal en una pared aórtica debilitada.
El tratamiento de la úlcera aterosclerótica penetrante sintomática en la fase aguda debería ser similar al de los otros síndromes aórticos agudos, dado el riesgo de rotura aórtica. Fuera de la fase aguda, el tratamiento dependerádel patrón de evolución, según los síntomas, la dilatación progresiva o el resangrado de la pared aórtica. Cuando no se disponía del tratamiento endovascular, la cirugía implicaba un riesgo no despreciable en pacientes ateroscleróticos y seniles, y no era infrecuente observar que muchas úlceras aórticas permanecían totalmente estables a corto-medio plazo. No obstante, creemos que en las úlceras de un tamaño considerable, sobre todo si se van dilatando o generan resangrado en la pared de la aorta diagnosticados por resonancia magnética, estaría indicado el tratamiento endovascular.
Todos los pacientes, incluso los tratados con cirugía o procedimientos endovasculares, deben recibir antihipertensivos a largo plazo, con betabloqueantes, bloqueantes de los canales de calcio e inhibidores de la enzima convertidora de la angiotensina (IECA). Casi todas las combinaciones de antihipertensivos se consideran aceptables, salvo los que actúan sobre todo como vasodilatadores (p. ej., hidralazina, minoxidilo) y los betabloqueantes con actividad simpaticomimética intrínseca (p. ej., acebutolol, pindolol). Se les suele recomendar a los pacientes que eviten la actividad física extenuante.
Debe solicitarse una RM o TAC antes del alta y repetirla a los 6 meses, al año y, a partir de entonces, cada 1 o 2 años.
Las complicaciones tardías más importantes son: la redisección, la formación de aneurismas localizados en la aorta debilitada, los síndromes de hipoperfusión visceral o de extremidades y la insuficiencia valvular aórtica progresiva. Estas complicaciones pueden requerir reparación quirúrgica o endovascular.
12.12 Bibliografía
1. Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
2. Rutherford´s Vascular Surgery. 8Th Edition. Rutherford. Jack L. Cronenwett MD, K. Wayne Jhonston. Elservier Saunders 2014.
3. DiMusto P, Williams D, Himanchu J Patel et al. Endovascular Mangement of Type B dissections. J Vasc Surg 2010, 52:26S-36S
4. Erbel R,Alfonso F, BoileauC, Dirsch O,Eber B,HaverichA,RakowskiH, StruyvenJ, Radegran K, Sechtem U, Taylor J, Zollikofer C, Klein WW, Mulder B, Providencia LA. Diagnosis and management of aortic dissection. Eur Heart J 2001; 22:1642–1681.
5. Reul GJ, Cooley DA, Hallman GL, Reddy SB, Kyger ER 3rd, Wukasch DC. Dissecting aneurysm of the escending aorta. Improved surgical results in 91 patients. Arch Surg 1975; 110:632–640
6. SvenssonLG,LabibSB, EisenhauerAC, Butterly JR.Intimal tear without hematoma: an important variant of aortic dissection that can elude current imaging techniques. Circulation 1999; 99:1331–1336.
7. Sampson UKA, Norman PE, Fowkes GR, Aboyans V, Song Y, Harrell FE, Forouzanfar MH, Naghavi M, Enenberg JO, McDermott MM, Criqui MH, Mensah GA, Ezzati M, Murray C. Global and regional burden of aortic dissection and aneurysms. Global Heart 2014;8:171–180
8. Hagan PG, Nienaber CA, Isselbacher EM, Bruckman D, Karavite DJ, Russman PL, Evangelista A, Fattori R, Suzuki T, Oh JK, Moore AG, Malouf JF, Pape LA, Gaca C, Sechtem U, Lenferink S, Deutsch HJ, Diedrichs H, Marcos y Robles J, Llovet A, Gilon D, Das SK, Armstrong WF, Deeb GM, Eagle KA. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA 2000; 283:897–903
9. Januzzi JL, Eagle KA, Cooper JV, Fang J, Sechtem U, Myrmel T, Evangelista A, Oh JK, Llovet A, O’Gara PT, Nienaber CA, Isselbacher EM. Acute aortic dissection presenting with congestive heart failure: results from the International Registry of Acute Aortic Dissection. J Am Coll Cardiol 2005; 46:733–735.
10. Bonnefoy E, Godon P, Kirkorian G, Chabaud S, Touboul P. Significance of serum troponin I elevation in patients with acute aortic dissection of the ascending aorta. Acta Cardiol 2005; 60:165–170.
11. Gilon D, Mehta RH, Oh JK, Januzzi JL Jr., Bossone E, Cooper JV, Smith DE, Fang J, Nienaber CA, Eagle KA, Isselbacher EM. Characteristics and in-hospital outcomes of patientswith cardiac tamponade complicating type A acuteaortic dissection. Am J Cardiol 2009; 103:1029–1031.
12. Di Eusanio M, Trimarchi S, Patel HJ, Hutchison S, Suzuki T, Peterson MD, Di Bartolomeo R, Folesani G, Pyeritz RE, Braverman AC, Montgomery DG, Isselbacher EM, Nienaber CA, Eagle KA, Fattori R. Clinical presentation, management, and short-term outcome of patients with type A acute dissection complicated by mesenteric malperfusion: observations from the International Registry of Acute Aortic Dissection. J Thorac Cardiovasc Surg 2013; 145:p385–390 e1.
13. Moro H, Hayashi J, Sogawa M. Surgical management of the ruptured aortic arch. Ann Thorac Surg 1999; 67:593–594.
14. Trimarchi S, Tolenaar JL, Tsai TT, Froehlich J, Pegorer M, Upchurch GR, Fattori R, Sundt TM 3rd, Isselbacher EM, Nienaber CA, Rampoldi V, Eagle KA. Influence of clinical presentation on the outcome of acute B aortic dissection: evidences from IRAD. J Cardiovasc Surg (Torino) 2012; 53:161–168.
15. Klompas M. Does this patient have an acute thoracic aortic dissection? JAMA 2002; 287:2262–2272.
16. JexRK,SchaffHV,PiehlerJM,OrszulakTA,PugaFJ,KingRM,DanielsonGK,PluthJR. Repair of ascending aortic dissection. Influence of associated aortic valve insufficiency on early and late results. J Thorac Cardiovasc Surg 1987; 93:375–384.
17. Erbel R, Oelert H, Meyer J, Puth M, Mohr-Katoly S, Hausmann D, Daniel W, Maffei S, Caruso A, Covino FE. Effect of medical and surgical therapy on aortic dissection evaluated by transesophageal echocardiography. Implications for prognosis and therapy. The EuropeanCooperativeStudy Group onEchocardiography. Circulation1993; 87 :1604–1615.
18. Janosi RA, Buck T, Erbel R. Mechanism of coronary malperfusion due to type-a aortic dissection. Herz 2009;34:478.
19. Bossone E, Corteville DC, Harris KM, Suzuki T, Fattori R, Hutchison S, Ehrlich MP, Pyeritz RE, Steg PG, Greason K, Evangelista A, Kline-Rogers E, Montgomery DG, Isselbacher EM, Nienaber CA, Eagle KA. Stroke and outcomes in patients with acute type A aortic dissection. Circulation 2013; 128:S175–S179.
20. Rogers AM, Hermann LK, Booher AM, Nienaber CA, Williams DM, Kazerooni EA, Froehlich JB, O’Gara PT, Montgomery DG, Cooper JV, Harris KM, Hutchison S, Evangelista A, Isselbacher EM, Eagle KA. Sensitivity of the aortic dissection detection risk score, a novel guideline-based tool for identification of acute aortic dissection at initial presentation: results from the international registry of acute aortic dissection. Circulation 2011; 123 :2213–2218.
21. Eggebrecht H, Mehta RH, Metozounve H, Huptas S, Herold U, Jakob HG, Erbel R. Clinical implications of systemic inflammatory response syndrome following thoracic aortic stent-graft placement. J Endovasc Ther 2008; 15:135–143.
22. Suzuki T, Bossone E, Sawaki D, Janosi RA, Erbel R, Eagle K, Nagai R. iomarkers of aortic diseases. Am Heart J 2013;165:15–25.
23. Taylor RA, Iyer NS. A decision analysis to determine a testing threshold for computed tomographic angiography and D-dimer in the evaluation of aortic dissection. Am J Emerg Med 2013; 31:1047–1055.
24. Shimony A, Filion KB, Mottillo S, Dourian T, Eisenberg MJ. Meta-analysis of usefulness of d-dimer to diagnose acute aortic dissection. Am J Cardiol 2011;107:1227–1234.
25. Suzuki T, Distante A, Zizza A, Trimarchi S, Villani M, Salerno Uriarte JA, De Luca, Tupputi ,Schinosa L, Renzulli A, Sabino F, Nowak R, Birkhahn R, Hollander JE, Counselman F, Vijayendran R, Bossone E, Eagle K. Diagnosis of acute aortic dissection by D-dimer: the International Registryof Acute Aortic Dissection Substudyon Biomarkers (IRAD-Bio) experience. Circulation 2009; 119:2702–2707.
26. Sutherland A,EscanoJ,CoonTP. D-dimerasthe sole screening test for acute aortic dissection: a review of the literature. Ann Emerg Med 2008; 52:339–343.
27. Suzuki T, Distante A, Zizza A, Trimarchi S, Villani M, Salerno Uriarte JA, de Luca Tupputi Schinosa L, Renzulli A, Sabino F, Nowak R, Birkhahn R, Hollander JE, Counselman F, Bossone E, Eagle K. Preliminary experience with the smooth muscle troponin-like protein, calponin, as a novel biomarker for diagnosing acute aortic dissection. Eur Heart J 2008; 29:1439–1445.
28. Giachino F, Loiacono M, Lucchiari M, Manzo M, Battista S, Saglio E, Lupia E, Moiraghi C, Hirsch E, Mengozzi G, Morello F. Rule out of acute aortic dissection with plasma matrix metalloproteinase 8 in the emergency department. Crit Care 2013; 17:R33.
29. Nozato T, Sato A, Hirose S, Hikita H, Takahashi A, Endo H, Imanaka-Yoshida K, Yoshida T, Aonuma K, Hiroe M. Preliminary study of serum tenascin-C levels as a diagnostic or prognostic biomarker of type B acute aortic dissection. Int J Cardiol 2013;168:4267–4269.
30. Erbel R, Mohr-Kahaly S, Oelert H, Iversen S, Jakob H, Thelen M, Just M, Meyer J. [Diagnostic goals in aortic dissection. Value of transthoracic and transesophageal echocardiography].Herz 1992; 17:321–337.
31. Nienaber CA, von Kodolitsch Y, Nicolas V, Siglow V, Piepho A, Brockhoff C, Koschyk DH, Spielmann RP. The diagnosis of thoracic aortic dissection by noninvasive imaging procedures. N Engl J Med 1993; 328:1–9.
32. Mintz GS, Kotler MN, Segal BL, Parry WR. Two dimensional echocardiographic recognition of the descending thoracic aorta. Am J Cardiol 1979; 44:232–238.
33. Khandheria BK, Tajik AJ, Taylor CL, Safford RE, Miller FA Jr., Stanson AW, Sinak LJ, Oh JK, Seward JB. Aortic dissection: review of value and limitations of two dimensional echocardiography in a six-year experience. J Am Soc Echocardiogr 1989; 2:17–24.
34. Iliceto S, Ettorre G, Francioso G, Antonelli G, Biasco G, Rizzon P. Diagnosis of aneurysm of the thoracic aorta. Comparison between two non invasive techniques: two-dimensional echocardiography and computed tomography. Eur Heart J 1984; 5:545–555.
35. Erbel R, Engberding R, Daniel W, Roelandt J, Visser C, Rennollet H. Echocardiography in diagnosis of aortic dissection. Lancet 1989; 1:457–461.
36. Mohr-Kahaly S,Erbel R, Rennollet H, Wittlich N,Drexler M, Oelert H, Meyer J. Ambulatory follow-up of aortic dissection by transesophageal two-dimensional and color-coded Doppler echocardiography. Circulation1989; 80:24–33.
37. Gueret P, Senechal C, Roudaut R, Cormier B, Wolf J, Tribouilloy C, Cohen A, Lusson J, Bensaid J. Comparison of transesophageal and transthoracic echocardiography in acute aortic dissection. A multi-center prospective study. J Am Coll Cardiol 1991; 17:A260.
38. Demos TC, Posniak HV, Churchill RJ. Detection of the intimal flap of aortic dissection on unenhanced CT images. AJR Am J Roentgenol 1986; 146:601–603.
39. Kaji S, Nishigami K, Akasaka T, Hozumi T, Takagi T, Kawamoto T, Okura H, Shono H, Horibata Y, Honda T, Yoshida K. Prediction of progression or regression of type A aortic intramural hematoma by computed tomography. Circulation 1999;100:II281–II286.
40. Rubin GD. Helical CT angiography of the thoracic aorta. J Thorac Imaging 1997; 12:128–149.
41. Rubin GD, Beaulieu CF, Argiro V, Ringl H, Norbash AM, Feller JF, Dake MD, Jeffrey RB, Napel S. Perspective volume rendering of CT and MR images: applications for endoscopic imaging. Radiology 1996; 199:321–330.
42. GarzonG,Fernandez-Velilla M,Marti M, AcitoresI,Ybanez F, Riera L. Endovascular stent-graft treatment of thoracic aortic disease. Radiographics 2005; 25Suppl 1:S229–S244.
43. LePage MA, Quint LE, Sonnad SS, Deeb GM, Williams DM. Aortic dissection: CT features that distinguish true lumen from false lumen. AJR Am J Roentgenol 2001; 177:207–211.
44. Sommer T, Fehske W, Holzknecht N, Smekal AV, Keller E, Lutterbey G, Kreft B, Kuhl C, Gieseke J, Abu-Ramadan D, Schild H. Aortic dissection: a comparative study of diagnosis with spiral CT, multiplanar transesophageal echocardiography, and MR imaging. Radiology 1996; 199:347–352.
45. Kaji S, Akasaka T, Horibata Y, Nishigami K, Shono H, Katayama M, Yamamuro A, Morioka S, Morita I, Tanemoto K, Honda T, Yoshida K. Long-term prognosis of patients with type a aortic intramural hematoma. Circulation 2002; 106:I248–I252.
46. Novelline RA, Rhea JT, Rao PM, Stuk JL. Helical CT in emergency radiology. Radiology 1999; 213:321–339.
47. Kucich VA, Vogelzang RL, Hartz RS, LoCicero J 3rd, Dalton D. Ruptured thoracic aneurysm: unusual manifestation and early diagnosis using CT. Radiology 1986; 160:87–89.
48. Johnson TR, Nikolaou K, Wintersperger BJ, Knez A, Boekstegers P, Reiser MF, Becker CR. ECG-gated 64-MDCT angiography in the differential diagnosis of acute chest pain. AJR Am J Roentgenol 2007; 188:76–82.
49. Batra P, Bigoni B, Manning J, Aberle DR, Brown K, Hart E, Goldin J. Pitfallsin the diagnosis of thoracic aortic disection at CT angiography. Radiographics 2000; 20:309–20.
50. Posniak HV, Olson MC, Demos TC. Aortic motion artifact simulating dissection on CT scans: elimination with reconstructive segmented images. AJR Am J Roentgenol 1993; 161:557–558.
51. Raptopoulos VD, Boiselle PB, Michailidis N, Handwerker J, Sabir A, Edlow JA, Pedrosa I, Kruskal JB. MDCT angiography of acute chest pain: evaluation of ECG-gated and nongated techniques. AJR Am J Roentgenol 2006;186:S346–S356.
52. Loubeyre P, Angelie E, Grozel F, Abidi H, Minh VA. Spiral CT artifact that simulatesaortic dissection: image reconstruction with use of 180 degrees and 360 egrees linear-interpolation algorithms. Radiology1997; 205:153–157.
53. 186. Deutsch HJ, Sechtem U, Meyer H, Theissen P, Schicha H, Erdmann E. Chronic aortic dissection: comparison of MR Imaging and transesophageal echocardiography. Radiology 1994; 192:645–650. ESC Guidelines 2925
54. Sakamoto I, Sueyoshi E, Uetani M. MR imaging of the aorta. Radiol Clin North Am 2007; 45:485–497
55. Bogaert J, Meyns B, Rademakers FE, Bosmans H, Verschakelen J, Flameng W, Marchal G, Baert AL. Follow-up of aortic dissection: contribution of MR angiography for evaluation of the abdominal aorta and its branches. Eur Radiol 1997; 7:695–702.
56. Wagner S, Auffermann W, Buser P, Lim TH, Kircher B, Pflugfelder P, Higgins CB. Diagnostic accuracy and estimation of the severity of valvular regurgitation from the signal void on cine magnetic resonance images. Am Heart J 1989; 118:760–767.
57. van Rossum AC, Post JC, Visser CA. Coronary imaging using MRI.Herz 1996; 21:97–105.
58. Pelc NJ, Herfkens RJ, Shimakawa A, Enzmann DR. Phasecontrastcine magnetic resonance imaging. Magn Reson Q 1991;7:229–254.
59. Hona T,Hamada M, Matsumoto Y, Matsuoka H, Hiwada K. Diagnosis of Thrombus and Blood Flow in Aortic Aneurysm Using Tagging Cine Magnetic Resonance Imaging. Int J Angiol 1999; 8:57–61.
60. Chiappini B, Schepens M, Tan E, Dell’ Amore A, Morshuis W, Dossche K, Bergonzini M, Camurri N, Reggiani LB, Marinelli G, Di Bartolomeo R. Early and late outcomes of acute type A aortic dissection: analysis of risk factors in 487 consecutive patients. Eur Heart J 2005; 26:180–186.
61. Trimarchi S, Nienaber CA, Rampoldi V, Myrmel T, Suzuki T, Mehta RH, Bossone E,Cooper JV, Smith DE, Menicanti L, Frigiola A, Oh JK, Deeb MG, Isselbacher EM,Eagle KA. Contemporary results of surgery in acute type A aortic dissection: The International Registry of Acute Aortic Dissection experience. J Thorac Cardiovasc Surg 2005;129:112–122.
62. Perko MJ, Norgaard M, Herzog TM, Olsen PS, Schroeder TV, Pettersson G. Unoperated aortic aneurysm: a survey of 170 patients.Ann Thorac Surg 1995;59:1204–1209.
63. Trimarchi S, Eagle KA, Nienaber CA, Rampoldi V, Jonker FH, De Vincentiis C, Frigiola A, Menicanti L, Tsai T, Froehlich J, Evangelista A, Montgomery D, Bossone E, Cooper JV, Li J, Deeb MG, Meinhardt G, Sundt TM, Isselbacher EM. Role of age in acute type A aortic dissection outcome: report from the International Registry of Acute Aortic Dissection (IRAD). J Thorac Cardiovasc Surg 2010; 140:784–789.
64. Tang GH, Malekan R, Yu CJ, Kai M, Lansman SL, Spielvogel D. Surgery for acute type A aortic dissection in octogenarians is justified. J Thorac Cardiovasc Surg 2013;145:S186–S190.
65. Shrestha M, Khaladj N, Haverich A, Hagl C. Is treatment of acute type A aortic dissection in septuagenarians justifiable? Asian Cardiovasc Thorac Ann 2008;16:33–36.
66. Bonser RS, Ranasinghe AM, Loubani M, Evans JD, Thalji NM, Bachet JE, Carrel TP, Czerny M, Di Bartolomeo R, Grabenwoger M, Lonn L, Mestres CA, Schepens MA, Weigang E. Evidence, lack of evidence, controversy, and debate in the provision and performance of the surgery of acute type A aortic dissection.J Am Coll Cardiol 2011; 58:2455–2474.
67. Urbanski PP, Hijazi H, Dinstak W, Diegeler A. Valve-sparing aortic root repair in acute type A dissection: how manys iuses have to be repaired for curative surgery? Eur J Cardiothorac Surg2013; 44:439–443; discussion 443–444.
68. Hess PJ Jr., Klodell CT, Beaver TM, Martin TD. The Florida sleeve: a new technique for aortic root remodeling with preservation of the aortic valve and sinuses. Ann Thorac Surg 2005; 80:748–750.
69. Subramanian S, Leontyev S, Borger MA, Trommer C, Misfeld M, Mohr FW. Valve-sparing root reconstruction does not compromise survival in acute type A aortic dissection. Ann Thorac Surg 2012; 94 :1230–1234.
70. Shrestha M, Baraki H, Maeding I, Fitzner S, Sarikouch S, Khaladj N, Hagl C, Haverich. Long-term results after aortic valve-sparing operation (David I).Eur J Cardiothorac Surg 2012; 41:56–61; discussion 61–62.
71. Leontyev S, Borger MA, Etz CD, Moz M, Seeburger J, Bakhtiary F, Misfeld M, Mohr FW. Experience with the conventional and frozen elephant trunk techniques: a single-centre study. Eur J Cardiothorac Surg 2013; 44:1076–1082; discussion 1083.
72. Tsagakis K, Pacini D, Di Bartolomeo R, Gorlitzer M, Weiss G, Grabenwoger M, Mestres CA, Benedik J, Cerny S, Jakob H. Multicenter early experience with extended aortic repair in acute aortic dissection: is simultaneous descending stent grafting justified? J Thorac Cardiovasc Surg 2010; 140:S116–S120; discussion S142–S146.
73. Shrestha M, Pichlmaier M, Martens A, Hagl C, Khaladj N, Haverich A. Total aortic arch replacement with a novel four-branched frozen elephant trunk graft: first-in-man results. Eur J Cardiothorac Surg 2013; 43:406–410.
74. Di Eusanio M, Schepens MA, Morshuis WJ, Dossche KM, Kazui T, Ohkura K, Washiyama N, Di Bartolomeo R, Pacini D, Pierangeli A. Separate grafts or en bloc anastomosis for arch vessels reimplantation to the aortic arch. Ann Thorac Surg 2004; 77:2021–2028.
75. Kazui T, Washiyama N, Muhammad BA, Terada H, Yamashita K, Takinami M, Tamiya Y. Extended total arch replacement for acute type a aortic dissection: experience with seventy patients. J Thorac Cardiovasc Surg 2000; 119:558–565.
76. Pocar M, Passolunghi D, Moneta A, Donatelli F. Recovery of severe neurological dysfunction after restoration of cerebral blood flow in acute aortic dissection. Interact Cardiovasc Thorac Surg 2010; 10:839–841.
77. Tsukube T, Hayashi T, Kawahira T, Haraguchi T, Matsukawa R, Kozawa S, Ogawa K,Okita Y. Neurological outcomes after immediate aortic repair for acute type A aortic dissection complicated by coma. Circulation 2011; 124:S163–S167.
78. Williams DM, Brothers TE, Messina LM. Relief of mesenteric ischemia in type III aortic dissection with percutaneous fenestration of the aortic septum. Radiology 1990; 174:450–452.
79. Eggebrecht H, Baumgart D, Dirsch O, Erbel R. Percutaneous balloon fenestration of the intimal flap for management of limb threatening ischaemia in acute aortic dissection. Heart 2003; 89:973.
80. Bartel T, Eggebrecht H, Ebradlidze T, Baumgart D, Erbel R. Images in cardiovascular medicine. Optimal guidance for intimal flap fenestration in aortic dissection by transvenous two-dimensional and Doppler ultrasonography. Circulation 2003; 107:e17–e18.
81. Beregi JP, Prat A, Gaxotte V,Delomez M, McFadden EP. Endovascular treatment for dissection of the descending aorta. Lancet 2000; 356:482–483.
82. Midulla M, Renaud A, Martinelli T, Koussa M, Mounier-Vehier C, Prat A, Beregi JP. Endovascular fenestration in aortic dissection with acute malperfusion syndrome:immediate and late follow-up. J Thorac Cardiovasc Surg 2011; 142 :66–72.
83. Zimpfer D, Czerny M, Kettenbach J, Schoder M, Wolner E, Lammer J, Grimm M. Treatment of acute type a dissection by percutaneous endovascular stent-graft placement. Ann Thorac Surg 2006; 82:747–749.
84. Metcalfe MJ, Holt PJ, Hinchliffe RJ, Morgan R, Loftus IM, Thompson MM. Fenestrated endovascular aneurysm repair: graft complexity does not predict outcome. J Endovasc Ther 2012; 19:528–535.
85. Nienaber CA, Rousseau H, Eggebrecht H, Kische S, Fattori R, Rehders TC, Kundt G, Scheinert D, Czerny M, Kleinfeldt T, Zipfel B, Labrousse L, Ince H. Randomized comparison of strategies for type B aortic dissection: the INvestigation of STEnt Grafts in Aortic Dissection (INSTEAD) trial. Circulation 2009; 120:2519–2528.
86. Nienaber CA, Kische S, Rousseau H, Eggebrecht H, Rehders TC, Kundt G, Glass A, Scheinert D, Czerny M, Kleinfeldt T, Zipfel B, Labrousse L, Fattori R, Ince H. Endovascular repair of type B aortic dissection: long-term results of the randomized investigation of stent grafts in aortic dissection trial. Circ Cardiovasc Interv 2013; 6:407–416.
87. Fttori R, Montgomery D, Lovato L, Kische S, Di Eusanio M, Ince H, Eagle KA, Isselbacher EM, Nienaber CA. Survival after endovascular therapy in patients with type B aortic dissection: a report from the International Registry of Acute Aortic Dissection (IRAD). JACC Cardiovasc Interv 2013; 6:876–882.
88. Weiss G, Wolner I, Folkmann S, Sodeck G, Schmidli J, Grabenwoger M, Carrel T, Czerny M. The location of the primary entry tear in acute type B aortic dissection affects early outcome. Eur J Cardiothorac Surg 2012; 42:571–576.
89. Heijmen RH, Thompson MM, Fattori R, Goktay Y, Teebken OE, Orend KH. Valiant thoracicstent-graft deployed with the new captivia delivery system: proceduraland 30-day results of the Valiant Captivia registry. J Endovasc Ther 2012; 19 :213–225.
90. Bozinovski J, Coselli JS. Outcomes and survival in surgical treatment of descending thoracic aorta with acute dissection. Ann Thorac Surg 2008; 85:965–970.
91. Lansman SL, Hagl C, Fink D, Galla JD, Spielvogel D, Ergin MA, Griep RB. Acute type B aortic dissection: surgical therapy. Ann Thorac Surg 2002; 74:S1833–S1835;discussion S1857–S1863.
92. Fattori R, Tsai TT, Myrmel T, Evangelista A, Cooper JV, Trimarchi S, Li J, Lovato L, Kische S, Eagle KA, Isselbacher EM, Nienaber CA. Complicated acute type B dissection: is surgery still the best option?: a report from the International Registry of Acute Aortic Dissection. JACC Cardiovasc Interv 2008; 1:395–402.
93. Weiss G, Tsagakis K, Jakob H, Di Bartolomeo R, Pacini D, Barberio G, Mascaro J, Mestres CA, Sioris T, Grabenwoger M. The frozen elephant trunk technique for the treatment of complicated type B aortic dissection with involvement of the aortic arch: multicentre early experience. Eur J Cardiothorac Surg 2014.
94. Murzi M, Tiwari KK, Farneti PA, Glauber M. Might type A acute dissection repair with the addition of a frozen elephant trunk improve long-term survival compared to standard repair? Interact Cardiovasc Thorac Surg 2010; 11:98–102.
95. von Kodolitsch Y, Csosz SK, Koschyk DH, Schalwat I, Loose R, Karck M, DieckmannC, Fattori R, Haverich A, Berger J, Meinertz T, Nienaber CA.Intramural hematoma of the aorta: predictors of progression to dissection and rupture. Circulation 2003; 107:1158–1163.
96. Evangelista A, Mukherjee D, Mehta RH, O’Gara PT, Fattori R, Cooper JV, Smith DE, Oh JK, Hutchison S, Sechtem U, Isselbacher EM, Nienaber CA, Pape LA, Eagle KA. Acute intramural hematoma of the aorta: a mystery in evolution. Circulation 2005; 111:1063–1070.
97. Song JK. Diagnosis of aortic intramural haematoma. Heart 2004; 90 :368–371.
98. CecconiM,ChirilloF,CostantiniC,IacoboneG,LopezE,ZanoliR,GiliA,MorettiS, Manfrin M, Munch C, Torracca L, Perna GP. The role of transthoracic echocardiography in the diagnosis and management of acute type A aortic syndrome. Am Heart J 2012; 163:112–118. ESC Guidelines 2926
99. O’Gara PT, DeSanctis RW. Acute aortic dissection and its variants. Toward a common diagnostic and therapeutic approach. Circulation 1995; 92:1376–1378.
100. Bluemke DA. Definitive diagnosis of intramural hematoma of the thoracic aorta with MR imaging. Radiology 1997; 204:319–321.
101. Murray JG, Manisali M, Flamm SD, VanDyke CW, Lieber ML, Lytle BW, White RD. Intramural hematoma of the thoracicaorta: MR image findings and their prognostic implications. Radiology 1997; 204:349–355.
102. Evangelista A, Dominguez R, Sebastia C, Salas A, Permanyer-Miralda G, AveglianoG, Elorz C, Gonzalez-Alujas T, GarciaDelCastilloH, Soler-Soler J. Long-term follow-up of aortic intramural hematoma: predictors of outcome. Circulation 2003; 108:583–589.
103. Estrera A, Miller C 3rd, Lee TY, De Rango P, Abdullah S, Walkes JC, Milewicz D, Safi H. Acute type A intramural hematoma: analysis of current management strategy. Circulation 2009; 120:S287–S291.
104. Harris KM, Braverman AC, Eagle KA, Woznicki EM, Pyeritz RE, Myrmel T, Peterson MD, Voehringer M, Fattori R, Januzzi JL, Gilon D, Montgomery DG, Nienaber CA, Trimarchi S, Isselbacher EM, Evangelista A. Acute aortic intramural hematoma: an analysis from the International Registry of Acute Aortic Dissection. Circulation 2012; 126:S91–S96.
105. Kan CB, Chang RY, Chang JP. Optimal initial treatment and clinical outcome of type A aortic intramural hematoma: a clinical review. Eur J Cardiothorac Surg 2008; 33:1002–1006.
106. Kitai T, Kaji S, Yamamuro A, Tani T, Tamita K, Kinoshita M, Ehara N, Kobori A, Nasu M,Okada Y, FurukawaY. Clinical outcomes of medical therapy and timely operation in initially diagnosed type a aortic intramural hematoma: a 20-year experience. Circulation 2009; 120:S292–S298.
107. Song JK, Yim JH, Ahn JM, Kim DH, Kang JW, Lee TY, Song JM, Choo SJ, Kang DH, Chung CH, Lee JW, Lim TH. Outcomes of patients with acute type a aortic intramural hematoma. Circulation 2009; 120 :2046–2052.
108. Ganaha F, Miller DC, Sugimoto K, Do YS, Minamiguchi H, Saito H, Mitchell RS, Dake MD. Prognosis of aortic intramural hematoma with and without penetrating atherosclerotic ulcer: a clinical and radiological analysis. Circulation 2002; 106:342–348.
109. Evangelista A, Dominguez R, Sebastia C, Salas A, Permanyer-Miralda G, Avegliano G, Gomez-Bosh Z, Gonzalez-Alujas T, Garcia del Castillo H, Soler-Soler J. Prognostic value of clinical and morphologic findings in short-term evolution of aortic intramural haematoma. Therapeutic implications. Eur Heart J 2004; 25:81–87.
110. Song JM, Kim HS, Song JK, Kang DH, Hong MK, Kim JJ, Park SW, Park SJ, Lim TH, Song MG. Usefulness of the initial noninvasive imaging study to predict the adverse outcome sin the medical treatment of acute type A aortic intramural hematoma. Circulation 2003; 108 Suppl 1:II324–II328.
111. Bosma MS, Quint LE, Williams DM, Patel HJ, Jiang Q, Myles JD.Ulcer like projections developing in noncommunicating aortic dissections: CT findings and natural history.AJR Am J Roentgenol 2009; 193:895–905.
112. Quint LE, Williams DM, Francis IR, Monaghan HM, Sonnad SS, Patel S, Deeb GM. Ulcerlike lesions of the aorta: imaging features and natural history. Radiology 2001; 218:719–723.
113. Wu MT, Wang YC, HuangYL, Chang RS, LiSC, Yang P, Wu TH, Chiou KR, Huang JS, Liang HL, Pan HB. Intramural blood pools accompanying aortic intramural hematoma: CT appearance and natural course. Radiology 2011; 258:705–713.
114. Timperley J, Ferguson JD, Niccoli G, Prothero AD, Banning AP. Natural history of intramural hematoma of the descending thoracic aorta. Am J Cardiol 2003;91:777–780.
115. 248. Sueyoshi E, Matsuoka Y, Imada T, Okimoto T, Sakamoto I, Hayashi K. New devel opment of an ulcerlike projection in aortic intramural hematoma: CT evaluation. Radiology 2002; 224:536–541.
116. Kitai T, Kaji S, Yamamuro A, Tani T, Kinoshita M, Ehara N, Kobori A, Kim K, Kita T, Furukawa Y. Detection of intimal defect by 64-row multidetector computed tomography in patients with acute aortic intramural hematoma. Circulation 2011;124:S174–S178.
117. Kitai T, Kaji S, Yamamuro A, Tani T, Kinoshita M, Ehara N, Kobori A, Kita T, Furukawa Y. Impact of new development of ulcer-like projection on clinical outcomes in patients with type B aortic dissection with closed and thrombosed false lumen. Circulation 2010; 122:S74–S80.
118. Bolger AF. Aortic intramural haematoma. Heart 2008; 94:1670–1674.
119. Eggebrecht H, Plicht B, Kahlert P, Erbel R. Intramural hematoma and penetrating ulcers: indications to endovascular treatment. Eur J Vasc Endovasc Surg 2009; 38:659–665.
120. 253. Nathan DP, Boonn W, Lai E, Wang GJ, Desai N, Woo EY, Fairman RM, Jackson BM. Presentation, complications, and natural history of penetrating atherosclerotic ulcer disease. J Vasc Surg 2012; 55:10–15.
121. Harris JA, Bis KG, Glover JL, Bendick PJ, Shetty A, Brown OW. Penetrating atherosclerotic ulcers of the aorta. J Vasc Surg 1994;19:90–98; discussion 98–99.
122. Botta L, Buttazzi K, Russo V, Parlapiano M, Gostoli V, Di Bartolomeo R, Fattori R.Endovascular repair for penetrating atherosclerotic ulcers of the descending thoracic aorta: early and mid-term results. Ann Thorac Surg 2008;85:987–992.
123. Coady MA, Rizzo JA, Elefteriades JA. Pathologic variants of thoracic aortic dissections. Penetrating atherosclerotic ulcers and intramural hematomas. Cardiol Clin 1999; 17:637–657.
124. Cho KR, Stanson AW, Potter DD, Cherry KJ, Schaff HV, Sundt TM 3rd. Penetrating atherosclerotic ulcer of the descending thoracic aorta and arch. J Thorac Cardiovasc Surg 2004; 127:1393–1399.
125. Troxler M, Mavor AI, Homer-Vanniasinkam S. Penetrating atherosclerotic ulcers of the aorta. Br J Surg 2001; 88 :1169–1177.
126. Eggebrecht H, Herold U, Schmermund A, Lind AY, Kuhnt O, Martini S, Kuhl H, Kienbaum P, Peters J, Jakob H, Erbel R, Baumgart D. Endovascular stent-graft treatment of penetrating aortic ulcer: results over a median follow-up of 27 months. Am Heart J 2006; 151:53053–6.
127. Brinster DR, Wheatley GH 3rd, Williams J, Ramaiah VG, Diethrich EB, Rodriguez-Lopez JA. Are penetrating aortic ulcers best treated using an endovascular approach?Ann Thorac Surg 2006; 82:1688–1691.
128. Demers P, Miller DC, Mitchell RS, Kee ST, Chagonjian L, Dake MD. Stent-graft repair of penetrating therosclerotic ulcers in the descending thoracic aorta: mid-term results. Ann Thorac Surg 2004; 77:81–86.
129. Demetriades D, Velmahos GC, Scalea TM, Jurkovich GJ, Karmy-Jones R, Teixeira PG, Hemmila MR, O’Connor JV, McKenney MO, Moore FO, London J, Singh MJ, Lineen E, Spaniolas K, Keel M, Sugrue M, Wahl WL, Hill J, Wall MJ, Moore EE, Margulies D, Malka V, Chan LS. Operative repair or endovascular stent graft in blunt traumatic thoracic aortic injuries: results of an American Association for the Surgery of Trauma Multicenter Study. J Trauma 2008; 64:561–70; discussion 570–571.
130. Shrestha M, Khaladj N, Baraki H, Al Ahmad A, Koigeldiyev N, Pichlmaier M, Haverich A, Hagl C. Aortic root reoperation: a technical challenge. J Heart Valve Dis 2010; 19:177–181.
131. Di Eusanio M, Berretta P, Bissoni L, Petridis FD, Di Marco L, Di Bartolomeo R. Re-operations on the proximal thoracic aorta: results and predictors of short and long-term mortality in a series of 174 patients. Eur J Cardiothorac Surg 2011; 40:1072–1076.
132. Leontyev S, Borger MA, Davierwala P, Walther T, Lehmann S, Kempfert J, Mohr FW. Redo aortic valve surgery: early and late outcomes. Ann Thorac Surg 2011; 91:1120–1126.
133. Coady MA,Rizzo JA, Hammond GL, Mandapati D, Darr U, Kopf GS, Elefteriades JA. What is the appropriate size criterion for resection of thoracic aortic aneurysms? J Thorac Cardiovasc Surg 1997; 113:476–491.
134. Jonker FH, Trimarchi S, Verhagen HJ, Moll FL, Sumpio BE, Muhs BE. Meta-analysis of open versus endovascular repair for ruptured descending thoracic aortic aneurysm. J Vasc Surg 2010; 51:1026–1032, 1032 e1–1032 e2.
135. Jonker FH, Verhagen HJ, Lin PH, Heijmen RH, Trimarchi S, Lee WA, Moll FL, Atamneh H, Rampoldi V, Muhs BE. Open surgery versus endovascular repair of ruptured thoracic aortic aneurysms. J Vasc Surg 2011; 53:1210–1216.
136. Gopaldas RR, Dao TK, LeMaire SA, Huh J, Coselli JS. Endovascular versus open repair of ruptured descending thoracic aortic aneurysms: a nationwide risk-adjusted study of 923 patients. J Thorac Cardiovasc Surg 2011; 142 :1010–1018