Capítulo 17 - Patología Oclusiva de T.S.A ( Troncos Supra Aórticos )
17.1 Introducción
El ictus es la primera causa de muerte por enfermedades neurológicas, la segunda en mortalidad cardiovascular y la tercera causa de muerte global.
La incidencia media de ictus es 1,6/1000 habitantes año y además de la mortalidad tiene una alta tasa de secuelas físicas y un alto coste económico.
Desde el último tercio del siglo XIX se conoce la relación entre ictus y enfermedad arterial de los troncos supraaórticos y en 1954 se realiza la primera intervención exitosa sobre una carótida que producía sintomatología neurológica.
En este tema vamos a estudiar aquellas lesiones oclusivas de los vasos que surgen del arco aórtico y de sus ramas durante el trayecto extracraneal.
Este tipo de lesiones, aún siendo importantes pueden ser asintomáticas, producir accidentes isquémicos transitorios (AIT) o ictus.
17.2 Anatomía
El diagnóstico y tratamiento de la enfermedad cerebro-vascular requiere un conocimiento de la anatomía de los troncos supraaórticos, que comienzan en el arco aórtico y finalizan en las arterias intracerebrales.
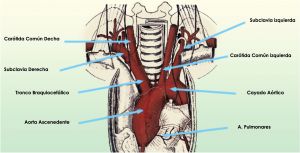
El cayado aórtico del 95% de la población da origen a tres grandes ramas: Tronco braquiocefálico (TBC), carótida común izquierda y subclavia izquierda. Las variantes anatómicas corresponden a menos del 2%.
Fig. 1 Arco aórtico y sus ramas
El tronco braquiocefálico (también llamado arteria innominada) es la primera rama que surge y la de mayor calibre. Se origina a nivel del manubrio esternal, sigue un trayecto póstero-superior y a 4-6 cm de su origen se bifurca en carótida común derecha y subclavia derecha (detrás de la unión costo-clavicular derecha).
La arteria subclavia derecha se origina del TBC y se dirige hacia axila y miembro superior derecho pasando detrás del músculo escaleno anterior. La arteria subclavia izquierda se origina directamente del arco aórtico, asciende lateralmente dentro del mediastino y se arquea hacia la cara posterior para pasar detrás del escaleno anterior a nivel de la fosa supraclavicular. Ambas arterias subclavias bordean la cúpula pleural. La arteria vertebral nace de la cara cefálica de la subclavia y es su primera rama; siguiendo un trayecto bastante recto penetra en el agujero transverso C6 y asciende a través de los agujeros transversos vertebrales hasta C1, se introduce en el cráneo por el agujero occipital y ascienden por la cara inferior del tronco del encéfalo para unirse con la vertebral contralateral en un único vaso: la arteria basilar. En un 25% de los casos ambas vertebrales presentan el mismo calibre, en el 50% la arteria vertebral izquierda es dominante y en el 25% restante es la vertebral derecha la dominante.
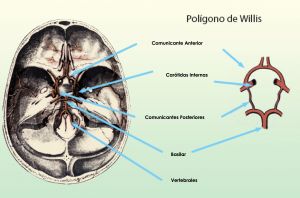
La arteria basilar junto con las carótidas internas dará lugar al Polígono de Willis.
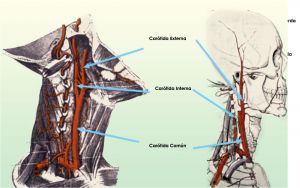
La arteria carótida común derecha se origina del TBC en la base del cuello mientras que la carótida común izquierda nace directamente del cayado de la aorta en el mediastino. Ambas arterias ascienden por el cuello por debajo y medialmente al músculo esternocleidomastoideo. A nivel del ángulo de la mandíbula se bifurcan en carótida interna y externa.
La arteria carótida externa tiene menor diámetro que la interna e irriga la cara, el cuero cabelludo, la oronasofaringe, el cráneo y las meninges. Estas ramas de la carótida externa tienen gran importancia en caso de obstrucción de la carótida interna o vertebral ya que pueden ser fuente de colateralidad.
La arteria carótida interna se divide en cinco grandes segmentos: bulbo, porción cervical, porción petrosa, porción cavernosa y porción cerebral. El bulbo se localiza en el origen de la carótida interna; el segmento cervical hasta su entrada en el orificio carotídeo del peñasco del temporal no contiene ramas importantes;en la porción petrosa, segmento que transcurre por el conducto carotídeo del peñasco. tampoco existen ramas importantes, pero existen pequeñas ramas pterigopalatinas que conectan con ramas etmoidales de la arteria maxilar interna y pueden servir de vías colaterales en casos de obstrucción; la porción cavernosa, que transcurre por el seno cavernoso, se denomina sifón carotídeo (forma de S) y en ella se origina la arteria oftálmica; la porción cerebral es la parte terminal de la carótida interna y cursa desde la la salida de la arteria oftálmica al final del sifón hasta donde se divide en sus ramas terminales:las arterias cerebrales anteriores y medias, que contribuyen a la formación del Polígono de Willis.
Fig. 2 Trayecto de arterias carótidas
El Polígono de Willis es un anillo vascular que rodea el diencéfalo (silla turca e hipófisis) y esta formado en su mitad anterior por la arteria comunicante anterior y cerebrales anteriores, la mitad posterior estaría formada por la carótida interna, las comunicantes posteriores, la arteria basilar y las arterias cerebrales posteriores, ramas terminales de la arteria basilar. Solo el 20% de la población tiene un anillo completo con todos los vasos presentes.
Fig. 3 Polígono de Willis
17.3 Etiología
La principal entidad responsable de la enfermedad oclusiva de los TSA es la aterosclerosis (90%). El 10% restante abarca entidades como la displasia fibromuscular, acodamientos arteriales secundarios a elongación, compresión extrínseca, traumatismos, disección intimal y las angiopatías inflamatorias.
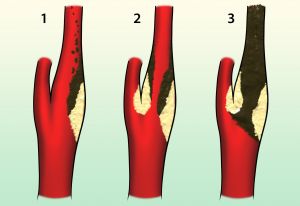
La aterosclerosis se manifiesta mediante depósitos de colesterol en la íntima arterial que generan una respuesta inflamatoria y proliferación de fibroblastos. Posteriormente pueden formarse depósitos de calcio. La lesión puede crecer lentamente dentro de un proceso ateromatoso típico o sufrir bruscas expansiones por hemorragias en el interior de la placa. En cualquier caso, la rotura intimal puede descargar hacia la luz del vaso numerosos detritus. Estas lesiones pueden favorecer la formación de agregados plaquetarios o trombos que posteriormente embolizen hacia la circulación cerebral.
Las lesiones ateromatosas ocurren habitualmente en las bifurcaciones y ostiums, principalmente en bifurcación carotídea, aunque también pueden localizarse en el origen de las ramas del cayado aórtico, origen de la arteria vertebral, en el sifón carotídeo y en el origen de arterias cerebrales (estos dos últimos son intracraneales).
La predilección de estas lesiones ateroscleróticas por la bifurcación carotídea se relaciona con la geometría del vaso, el perfil de la velocidad de flujo y la presión de cizallamiento parietal.
El 38% de las lesiones extra e intracraneales se localizan en la bifurcación carotídea, el 20% en el origen de la arteria vertebral, 9% en el origen de las ramas de la aorta y el 33% restante son intracraneales.
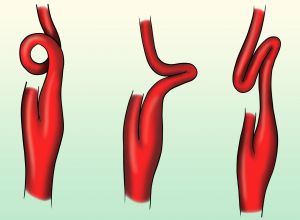
Elongación, tortuosidad y acodamiento están presentes en el 16-21% de los adultos y pueden variar desde una simple tortuosidad hasta bucles de 360º. En casos severos pueden existir acodamientos que condicionen una aparente reducción del flujo.
Fig. 4 Bucle, acodamiento y elongación
La displasia fibromuscular representa < 1% de las lesiones carotídeas y la forma de presentación más frecuente es la fibrodisplasia de la media con imagen arrosariada mas allá del bulbo carotídeo.
La compresión extrínseca se produce sobre todo a nivel de arterias vertebrales en su trayecto por el conducto vertebral óseo. También los tumores pueden rodear e invadir la carótida.
La radiación cervical para tratamiento tumoral puede inducir lesiones ateromatosas que estenosan u ocluyen los TSA.
Los traumatismos craneocervicales pueden obstruir la carótida interna por desgarro intimal y disección aguda. Pueden existir casos espontáneos de disección carotídea.
Las arteriopatías inflamatorias son raras pero pueden afectar a los grandes troncos de los TSA como en el caso de la enfermedad de Takayasu o la arteritis de la temporal. Menos frecuente son las obstrucciones producidas por vasculitis.
17.4 Fisiopatología
Durante años se ha debatido sobre los mecanismos por los que las lesiones carotídeas podían producir síntomas neurológicos. Dos teorías intentaban explicar los mecanismos: 1.- la teoría de la disminución del flujo (teoría de la estenosis) y 2.- la teoría del embolismo.
La primera teoría defiende que los AIT se producen por una disminución del flujo cerebral a partir de cierto grado de estenosis. Esta teoría ha perdido apoyos a medida que diferentes estudios no confirmaban esta hipótesis. Los defensores de la otra teoría argumentan que los AIT hemisféricos son resultado de la embolización plaquetaria desde la placa de ateroma. El hecho de que los AIT cesen completamente con la obstrucción de la arteria apoya esta teoría.
A veces, una placa de ateroma discreta en la carótida interna experimenta una hemorragia brusca en su interior que produce una obstrucción brusca de la luz de la arteria (hemorragia intraplaca).
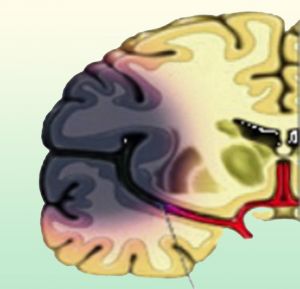
Fig. 5 Diferentes mecanismos por los que la aterosclerosis puede causar sintomatología neurológica
1. Teoría embolígena (ateroembolia) de agregados plaquetarios, fragmentos de placa que ocluyen vasos cerebrales mas distales.
2. Teoría hemodinámica. La placa genera una estenosis tan importante que la carótida es incapaz de suministrar un flujo de sangre suficiente para el cerebro (hipoperfusión cerebral).
3. Teoría oclusiva. Obstrucción brusca del flujo con trombosis retrógrada por evolución de una estenosis crítica o placa complicada (hemorragia intraplaca).
17.5 Clínica
La aterosclerosis a nivel de los TSA puede ser asintomática o dar lugar a sintomatología neurológica por los mecanismos anteriormente descritos.
Se habla de AIT (accidente isquémico transitorio) cuando los síntomas neurológicos son temporales, pudiendo duran entre unos minutos o varias horas, pero siempre menos de 24 horas. En general se considera un trastorno clínico menor, relativamente benigno y no mortal (actualmente, gracias a la RNM, encontramosque mas de la mitad de los pacientes con episodios de mas de una hora de duración y el 70% de los que presentan síntomas que duran entre 12 y 24 horas expresan lesiones isquémicas cerebrales), aunque en un 35% de los pacientes estos síntomas son precursores de accidentes cerebrovasculares mayores.
Cuando los síntomas duran mas de 24 horas se habla de infarto cerebral o ictus.
Los síntomas neurológicos, tanto del AIT como del ictus, pueden incluir:
En territorio carotídeo: alteraciones sensitivas o motoras de una parte del cuerpo o del hemicuerpo contralateral a la zona cerebral dañada, alteraciones del lenguaje (afasia, disartria,…), alteraciones visuales (ceguera temporal o amaurosis fugax, , visión borrosa…) que se presentan ipsilaterales, confusión, pérdida de memoria.
Territorio vertebrobasilar: ataxia, diplopía, vértigo, síndrome cruzado (cara de un lado y cuerpo y pares craneales del otro), síncope)
Fig. 6 Un coágulo bloquea el flujo de una arteria cerebral y produce un infarto
17.6 Pruebas Diagnósticas
Los antecedentes familiares y personales así como una correcta historia clínica pueden ofrecer indicios sobre la localización y causa de la isquemia.
La exploración física se debe centrar en el examen neurológico: conciencia, orientación, concentración, habla, pares craneales, fuerza, pérdida de sensibilidad, reflejos, coordinación y marcha. Es obligado la palpación de los pulsos en carótidas y miembros superiores así como la auscultación de soplos carotídeos o subclavios.
Las pruebas complementarias incluyen:
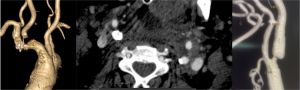
TAC o RNM de cráneo para diferenciar una hemorragia de una isquemia. La TAC, por su fácil disponibilidad en los servicios de urgencias, suele ser la primera prueba solicitada a los pacientes con sospecha de AIT o Ictus. Aunque en las primeras 24-72 horas puede no apreciarse ninguna lesión isquémica cerebral, descarta las lesiones hemorrágicas. La RNM supone un instrumento más útil para determinar el curso temporal de la isquemia además de permitir una mejor valoración de las lesiones de la fosa posterior (tronco del encéfalo ye infartos lacunares). Los estudios AngioTAC y AngioRNM constituyen métodos excelentes para valorar los vasos intra y extracraneales, a pesar de que la angioRNM puede sobrestimar las estenosis tiene la ventaja de ser mas exacta si se tratan de estenosis muy calcificadas.
Fig. 7 AngioTAC. Diferentes lesiones carotídeas
Los estudios analíticos deben comprender hemograma, coagulación, perfiles lipídico y metabólico básicos, VSG, hemoglobina A1c y homocistinemia. En pacientes jóvenes conviene ampliar el estudio a tóxicos en orina, perfil reumatológico, estudio de trombofilia y anticoagulantes lúpico, anticuerpos anticardiolipina y antifosfolípidos.
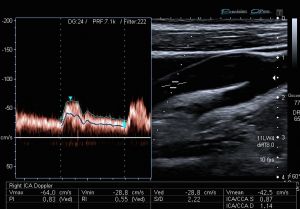
Ecografía doppler carotídea: es la técnica de imagen inicial que se utiliza para valorar la existencia de enfermedad carotídea. Como cualquier otra ecografía utiliza ondas sonoras para crear una imagen de las arterias carótidas. Permite evaluar la existencia de placas de ateroma, sus características y la severidad de la estenosis en función de la velocidad del flujo. Es una prueba rápida, no invasiva y muy fiable que permite establecer un diagnostico seguro en la mayoría de los casos. Es menos fiable para detectar lesiones muy proximales o distales, placas ulceradas o estenosis pre oclusivas.
Fig. 8 Eco-Doppler carotídeo
Dado que un alto porcentaje de ictus en ancianos está relacionado con la fibrilación auricular. Es imprescindible la realización de un EKG y una ecocardiografía transtorácica adicional para valorar cardiopatía, trombos cardiacos y calcular la fracción de eyección.
La arteriografía es una técnica invasiva, similar al cateterismo coronario, que requiere la punción de una arteria en el brazo o la pierna, la utilización de catéteres y de contraste para la visualización de las carótidas. Es la que proporciona imágenes de mayor calidad y la mejor información, sin embargo, también puede dar lugar a mayores complicaciones por lo que sólo se utiliza en caso de discordancia en pruebas mínimamente invasivas (eco doppler, angioTAC o angioRNM) o información no concluyente sobre el grado de estenosis en las mismas.
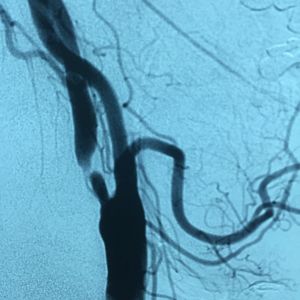
Fig. 9 Arteriografía. Estenosis crítica origen carótida interna
En función del grado de estenosis las lesiones se clasifican en:
I. 0-20% Estenosis leve
II. 21-50% Estenosis moderada
III. 51-70% Estenosis significativa
IV. 71-99% Estenosis severa-crítica
V. 100 Oclusión
17.7 Tratamiento
El tratamiento va a depender del grado de estenosis de las arterias, de si ha habido síntomas y del estado de salud general del paciente. El objetivo del tratamiento es prevenir el infarto/ isquemia cerebral. En todos los casos el manejo médico incluye:
• Control de los factores de riesgo: reducir los niveles de colesterol, controlar la diabetes y la hipertensión, hacer ejercicio regular y dejar de fumar son piedras angulares del tratamiento.
• Medicación antiagregante: Ácido acetilsalicílico (75-325 mg/día), Clopidogrel (75 mg/día), Dipridamol,...etc. Los fármacos antiagregantes actúan evitando que las plaquetas se peguen a una placa de ateroma complicada formando coágulos en las arterias carótidas y disminuyendo así el riesgo de ICTUS.
• Estatinas: Su uso ha demostrado estabilizar la placa de ateroma e incluso disminuir su tamaño y el riesgo de complicaciones dde la misma.
El riesgo de infarto es mayor cuanto mayor es el grado de estenosis carotídea, por lo que cuando la arteria presenta una estenosis significativa, es preciso además del tratamiento médico, realizar una intervención quirúrgica
¿Cuándo se precisa cirugía en la enfermedad arterial carotídea?
Durante la década de 1990 se realizaron numerosos estudios que tenían como objetivo identificar aquellos pacientes con enfermedad arterial carotídea que se beneficiarían de la cirugía para disminuir el riego de ICTUS. Los más relevantes son:
- NASCET (North American Symptomatic Carotid Endarterectomy Trial), se realizó en pacientes que habían presentado síntomas, es decir infarto cerebral o AIT debidos a enfermedad arterial carotídea, y concluyó que la cirugía es superior al tratamiento médico (sólo aspirina) en la prevención del ICTUS cuando la estenosis carotídea es igual o superior al 50%.
- El estudio ACST realizado en pacientes con enfermedad carotídea sin síntomas (sin historia de infarto cerebral) demostró que la cirugía disminuía el riesgo de ICTUS en comparación con el tratamiento solo con aspirina en pacientes con estenosis igual o superior al 70%.
La tromboendarterectomía carotídea (TEA)tiene un mayor beneficio a mayor grado de estenosis.
En pacientes sintomáticos con estenosis >70% proporciona un descenso absoluto del riesgo del 13%, mientras que en estenosis entre 51-70% la reducción es del 5%, no se ha encontrado beneficio en estenosis del 30-50% y el riesgo es mayor que el beneficio en <30%. Por tanto solo estaría indicada en estenosis sintomáticas >50% si la mortalidad es<6% y estaría contraindicada en estenosis <50%.
En pacientes asintomáticos la TEA está indicada si la estenosis es >70%, el riesgo asociado a la cirugía es <3%, la edad del paciente <75 años y la esperanza de vida >5 años. Si la estenosis es<70% solo está indicado tratamiento médico y seguimiento ecográfico cada 6-12 meses.
¿Cómo se realiza la cirugía de la estenosis carotídea?
La cirugía de la estenosis carotídea se denomina tromboendarterectomía carotídea. Puede realizarse con anestesia general o regional (con el paciente despierto). Durante la cirugía, se realiza un incisión en el cuello a lo largo del trayecto de los vasos carotídeos. Se disecan y controlan las arterias carótidas, se abren y se retira la placa. La arteria se puede cerrar directamente aunque normalmente se reconstruye con un parche que amplia la luz del vaso. Se cierra la herida de la piel.
Los principales riesgos de este procedimiento incluyen: sangrado, infección, infarto cerebral (1-3%), lesión de los pares craneales y sus ramas adyacentes a los vasos(en un 16% son normalmente transitorias: dificultad para hablar, tragar, desviación de la lengua, entumecimiento facial), infarto de miocardio.
La principal ventaja de esta cirugía en que es un procedimiento probado, duradero y con resultados establecidos en la prevención del infarto cerebral.
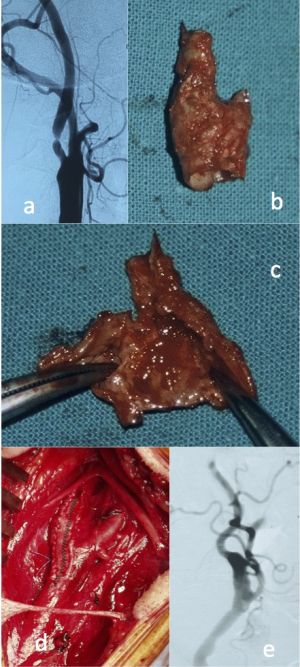
Fig. 10 Endarterectomía carotidea
a. Arteriografía. Estenosis origen de carótida int.
b. Placa ateroma endarterectomizada
c. Placa de ateroma expuesta
d. Cierre de carótida con parche de dacron
e. Control arteriográfico post endarterectomía
Tratamiento endovascular
El stent carotídeo ha surgido en los últimos años como un procedimiento alternativo a la cirugía carotídea.
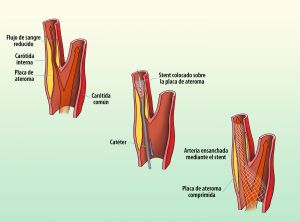
Esta técnica, similar al cateterismo y stent coronarios, se realiza con el paciente despierto, con anestesia local en la ingle, mediante punción de la arteria femoral. Se utiliza control radiológico, guías y catéteres para navegar a través de los vasos y alcanzar las arterias carótidas, una vez alcanzado el lugar de la estenosis, se despliega un stent (una pequeña malla metálica) que se abre acomodándose a las paredes del vaso y empujando la placa contra la pared aumentando así el espacio para el paso del flujo sanguíneo.
Fig. 11 Stent cónico para carótidas
Fig.12 Representación de implante stent
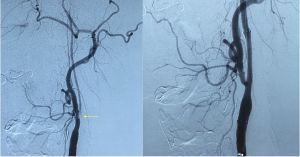
Fig. 13 Arteriografía pre y post implante stent carotídeo
La principal ventaja de esta técnica es que es un procedimiento menos invasivo: se realiza con anestesia local y no hace falta practicar ninguna incisión (por lo que evita el riesgo de dañar estructuras adyacentes a los vasos como los pares craneales).
Sin embargo, no está exenta de riesgos: durante el procedimiento también se pueden producir infartos cerebrales, arritmias, hipotensión; puede haber sangrado por el punto de punción, daño renal por el contraste, infarto cardiaco, estenosis y oclusión del stent.
No obstante, su principal inconveniente radica en que al ser una técnica más novedosa, se dispone de menos experiencia, información y estudios bien realizados que avalen sus resultados e indicaciones.
- La mayoría de los estudios que comparan cirugía con stent carotideo en pacientes sintomáticos (SHAPPHIRE, EVA 3S, SPACE..) concluyen que hoy por hoy la cirugía sigue siendo la mejor opción en estos pacientes ya que presenta menor riesgo de muerte e infarto cerebral perioperatorios, aunque mayor porcentaje de IAM no mortal.
- En pacientes asintomáticos, el numero de estudios es mucho menor y no aportan suficiente evidencia para recomendar el stent carotideo como tratamiento primario en estos pacientes. Algunos estudios sugieren resultados similares a la cirugía pero estos datos tienen que ser confirmados.
Actualmente las indicaciones del stent carotideo quedan por tanto limitadas a pacientes que por distintas razones no son candidatos para una intervención convencional:
• Pacientes que por su estado general de salud presentarían un riesgo de complicaciones elevado si se sometieran a una cirugía carotídea: insuficiencia cardiaca severa, infarto de miocardio reciente, enfermedad pulmonar importante…etc.
• Pacientes con lesiones no accesibles o poco accesibles a la cirugía: bifurcaciones carotídeas altas o extensión intracraneal de la lesión carotídea.
• Pacientes que por haberse sometido a cirugía o radioterapia previa a nivel del cuello presentan un tejido dañado y fibrótico que aumentaría el riesgo de lesión de los nervios craneales en la cirugía tradicional.
¿ Cómo se realiza el seguimiento de la enfermedad arterial carotídea?
Tanto en pacientes intervenidos (mediante cirugía convencional o stent), como en pacientes con estenosis carotídea que no alcanza el rango quirúrgico, el seguimiento es sencillo de realizar, una simple ecografía doppler realizada cada 6 o 12 meses permite vigilar la evolución de la enfermedad, estableciendo si existe progresión de la placa y del grado de estenosis o si la enfermedad permanece estable.
17.8 Bibliografía
1 2011ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS guideline on the management of patients with extracranial carotid and vertebral artery disease.
2 Surgery of the Arteries to the Head. Ramón Berguer y Edouard Kieffer. Editorial Springer-Verlag 1992.
3 Brott TG, Halperin JL, Abbara S, Bacharach JM, Barr JD, Bush RL, Cates CU, Creager MA, Fowler SB, Friday G, Hertzberg VS, McIff EB, Moore WS, Panagos PD, Riles TS, Rosenwasser RH, Taylor AJ, American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Stroke Assocation, American Association of Neuroscience Nurses, American Association of Neurological Surgeons, American College of Radiology, American Society of Neuroradiology, Congress of Neurolgocial Surgeons, Society of Atherosclerosis Imaging and Prevention, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of NeuroInterventional Surgery, Society for Vascular Medicine, Society for Vascular Surgery, American Academy of Neurology and Society of Cardiovascular Computed Tomography. Stroke. 2011;42(8):e464.
4 S. Narumi, M. Sasaki, T. Natori, M.Y. Oura, K. Ogasawara, M. Kobayashi, Y. Sato, Y. Ogasawara, J. Hitomi, and Y. Terayama. Carotid Plaque Characterization Using 3D T1-Weighted MR Imaging with Histopathologic Validation: A Comparison with 2D Technique. AJNR Am J Neuroradiol. Enero 2015.
5 Luca Saba, Michele Anzidei, Beatrice Cavallo Marincola, Mario Piga, Eytan Raz, Pier Paolo Bassareo, Alessandro Napoli, Lorenzo Mannelli, Carlo Catalano, Max Wintermark. Imaging of the Carotid Artery Vulnerable Plaque.Cardiovasc Intervent Radiol.
6 Nicolaides AN, Kakkos SK, Griffin M, Sabetai M, Dhanjil S, Tegos T et al (2005) Severity of asymptomatic carotid stenosis and risk of ipsilateral hemispheric ischaemic events: results from the ACSRS study. Eur J Vasc Endovasc Surg 30:275–284
7 Ricotta JJ, Aburahma A, Ascher E, Eskandari M, Faries P, Lal BK, Society for Vascular Surgery. Updated Society for Vascular Surgery . Guidelines for management of extracranial carotid disease: executive summary.. J Vasc Surg. 2011;54(3):832.
8 Brott TG, Halperin JL, Abbara S, et al. 2011. ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SS Guideline on the management of patients with extracranial carotid and vertebral artery disease. Stroke 2011; 42:e464.
9 Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
10 Cirugía Vascular. Sexta Edición. Rutherford. Elservier Saunders 2006.
11 Meschia JF, Bushnell C, Boden-Albala B, et al. Guidelines for the primary prevention of stroke: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014; 45:3754.
12 Meta-Analysis of Randomized Controlled Trials Comparing the Long-Term Outcomes of Carotid Artery Stenting Versus Endarterectomy. Sophie Vincent, Maria Eberg, MSc, Mark J. Eisenberg, MD, MPH and, Kristian B. Filion, PhD Circulation: Cardiovascular Quality and Outcomes.2015; 8: S99-S108
13 Grau AJ, Weimar C, Buggle F, Heinrich A, Goertler M, Neumaier S, Glahn J, Brandt T, Hacke W, Diener HC. Risk factors, outcome, and treatment in subtypes of ischemic stroke: the German stroke data bank. Stroke 2001;32: 2559–2566.
14 Barnett HJ, Taylor DW, Eliasziw M, Fox AJ, Ferguson GG, Haynes RB, Rankin RN, Clagett GP, Hachinski VC, Sackett DL, Thorpe KE, Meldrum HE. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med 1998;339:1415–1425.
15 European Carotid Surgery Trialists’ Collaborative Group. Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST). Lancet 1998;351:1379–1387.
16 Inzitari D, Eliasziw M, Gates P, Sharpe BL, Chan RK, Meldrum HE, Barnett HJ. The causes and risk of stroke in patients with asymptomatic internal-carotid-artery stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med 2000;342:1693–1700.
17 Halliday A, Mansfield A, Marro J, Peto C, Peto R, Potter J, Thomas D. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet 2004;363:1491–1502.
18 Abbott AL. Medical (nonsurgical) intervention alone is now best for prevention of stroke associated with asymptomatic severe carotid stenosis: results of a systematic review and analysis. Stroke 2009;40:e573–e583.
19 Schneider PA, Naylor AR. Transatlantic debate. Asymptomatic carotid artery stenosis—medical therapy alone versus medical therapy plus carotid endarterectomy or stenting. Eur J Vasc Endovasc Surg 2010;40:274–281.
20 Rothwell PM, Giles MF, Flossmann E, Lovelock CE, Redgrave JN, Warlow CP, Mehta Z. A simple score (ABCD) to identify individuals at high early risk of stroke after transient ischaemic attack. Lancet 2005;366:29–36.
21 Grant EG, Benson CB, Moneta GL, Alexandrov AV, Baker JD, Bluth EI, Carroll BA, Eliasziw M, Gocke J, Hertzberg BS, Katanick S, Needleman L, Pellerito J, Polak JF, Rholl KS, Wooster DL, Zierler RE. Carotid artery stenosis: gray-scale and Doppler US diagnosis—Society of Radiologists in Ultrasound Consensus Conference. Radiology 2003;229:340–346.
22 Wardlaw JM, Chappell FM, Stevenson M, De Nigris E, Thomas S, Gillard J, Berry E, Young G, Rothwell P, Roditi G, Gough M, Brennan A, Bamford J, Best J. Accurate, practical and cost-effective assessment of carotid stenosis in the UK. Health Technol Assess 2006;10:iii–iv, ix–x, 1–182.
23 Amarenco P, Bogousslavsky J, Callahan A 3rd, Goldstein LB, Hennerici M, Rudolph AE, Sillesen H, Simunovic L, Szarek M, Welch KM, Zivin JA. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006;355: 549–559.
24 Sillesen H, Amarenco P, Hennerici MG, Callahan A, Goldstein LB, Zivin J, Messig M, Welch KM. Atorvastatin reduces the risk of cardiovascular events in patients with carotid atherosclerosis: a secondary analysis of the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) trial. Stroke 2008;39:3297–3302.
25 Bond R, Rerkasem K, AbuRahma AF, Naylor AR, Rothwell PM. Patch angioplasty versus primary closure for carotid endarterectomy. Cochrane Database Syst Rev 2004;2:CD000160.
26 Mannheim D, Weller B, Vahadim E, Karmeli R. Carotid endarterectomy with a polyurethane patch versus primary closure: a prospective randomized study. J Vasc Surg 2005;41:403–407; discussion 407–408.
27 Cao PG, de Rango P, Zannetti S, Giordano G, Ricci S, Celani MG. Eversion versus conventional carotid endarterectomy for preventing stroke. Cochrane Database Syst Rev 2001;1:CD001921.
28 Lewis SC, Warlow CP, Bodenham AR, Colam B, Rothwell PM, Torgerson D, Dellagrammaticas D, Horrocks M, Liapis C, Banning AP, Gough M, Gough MJ. General anaesthesia versus local anaesthesia for carotid surgery (GALA): a multicentre, randomised controlled trial. Lancet 2008;372:2132–2142.
29 Halliday A, Harrison M, Hayter E, Kong X, Mansfield A, Marro J, Pan H, Peto R, Potter J, Rahimi K, Rau A, Robertson S, Streifler J, Thomas D. 10-year stroke prevention after successful carotid endarterectomy for asymptomatic stenosis (ACST-1): a multicentre randomised trial. Lancet 2010;376:1074–1084.
30 McKevitt FM, Randall MS, Cleveland TJ, Gaines PA, Tan KT, Venables GS. The benefits of combined anti-platelet treatment in carotid artery stenting. Eur J Vasc Endovasc Surg 2005;29:522–527.
31 Dalainas I, Nano G, Bianchi P, Stegher S, Malacrida G, Tealdi DG. Dual antiplatelet regime versus acetyl-acetic acid for carotid artery stenting. Cardiovasc Intervent Radiol 2006;29:519–521.
32 Roffi M, Sievert H, GrayWA, White CJ, Torsello G, Cao P, Reimers B, Mathias K, Setacci C, Schonholz C, Clair DG, Schillinger M, Grunwald I, Bosiers M, Abou-Chebl A, Moussa ID, Mudra H, Iyer SS, Scheinert D, Yadav JS, van Sambeek MR, Holmes DR, Cremonesi A. Carotid artery stenting versus surgery: adequate comparisons? Lancet Neurol 2010;9:339–341.
33 Barbato JE, Dillavou E, Horowitz MB, Jovin TG, Kanal E, David S, Makaroun MS. A randomized trial of carotid artery stenting with and without cerebral protection. J Vasc Surg 2008;47:760–765.
34 Macdonald S, Evans DH, Griffiths PD, McKevitt FM, Venables GS, Cleveland TJ, Gaines PA. Filter-protected versus unprotected carotid artery stenting: a randomised trial. Cerebrovasc Dis 2010;29:282–289.
35 Kastrup A, Nagele T, Groschel K, Schmidt F, Vogler E, Schulz J, Ernemann U. Incidence of new brain lesions after carotid stenting with and without cerebral protection. Stroke 2006;37:2312–2316.
36 Garg N, Karagiorgos N, Pisimisis GT, Sohal DP, Longo GM, Johanning JM, Lynch TG, Pipinos II. Cerebral protection devices reduce periprocedural strokes during carotid angioplasty and stenting: a systematic review of the current literature. J Endovasc Ther 2009;16:412–427.
37 Zahn R, Mark B, Niedermaier N, Zeymer U, Limbourg P, Ischinger T, Haerten K, Hauptmann KE, Leitner ER, Kasper W, Tebbe U, Senges J. Embolic protection devices for carotid artery stenting: better results than stenting without protection? Eur Heart J 2004;25:1550–1558.
38 Cremonesi A, Manetti R, Setacci F, Setacci C, Castriota F. Protected carotid stenting: clinical advantages and complications of embolic protection devices in 442 consecutive patients. Stroke 2003;34:1936–1941.
39 Jansen O, Fiehler J, Hartmann M, Bruckmann H. Protection or nonprotection in carotid stent angioplasty: the influence of interventional techniques on outcome data from the SPACE Trial. Stroke 2009;40:841–846.
40 Bonati LH, Jongen LM, Haller S, Flach HZ, Dobson J, Nederkoorn PJ, Macdonald S, aines PA, Waaijer A, Stierli P, Jager HR, Lyrer PA, Kappelle LJ, Wetzel SG, van der Lugt A, Mali WP, Brown MM, van der Worp HB, Engelter ST. New ischaemic brain lesions on MRI after stenting or endarterectomy for symptomatic carotid stenosis: a substudy of the International Carotid Stenting Study (ICSS). Lancet Neurol 2010;9:353–362.
41 Massop D, Dave R, Metzger C, Bachinsky W, Solis M, Shah R, Schultz G, Schreiber T, Ashchi M, Hibbard R. Stenting and angioplasty with protection in patients at high-risk for endarterectomy: SAPPHIRE Worldwide Registry first 2,001 patients. Catheter Cardiovasc Interv 2009;73:129–136.
42 Brott TG, Hobson RW 2nd, Howard G, Roubin GS, Clark WM, Brooks W, Mackey A, Hill MD, Leimgruber PP, Sheffet AJ, Howard VJ, Moore WS, Voeks JH, Hopkins LN, Cutlip DE, Cohen DJ, Popma JJ, Ferguson RD, Cohen SN, Blackshear JL, Silver FL, Mohr JP, Lal BK, Meschia JF. Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J Med 2010;363:11–23.
43 Stabile E, Salemme L, Sorropago G, Tesorio T, Nammas W, Miranda M, Popusoi G, Cioppa A, Ambrosini V, Cota L, Petroni G, Della Pietra G, Ausania A, Fontanelli A, Biamino G, Rubino P. Proximal endovascular occlusion for carotid artery stenting: results from a prospective registry of 1,300 patients. J Am Coll Cardiol 2010;55:1661–1667.
44 Roffi M, Mukherjee D, Clair DG. Carotid artery stenting vs. endarterectomy. Eur Heart J 2009;30:2693–2704.
45 Gray WA, Yadav JS, Verta P, Scicli A, Fairman R, Wholey M, Hopkins LN, Atkinson R, Raabe R, Barnwell S, Green R. The CAPTURE registry: results of carotid stenting with embolic protection in the post approval setting. Catheter Cardiovasc Interv 2007;69:341–348.
46 Katzen BT, Criado FJ, Ramee SR, Massop DW, Hopkins LN, Donohoe D, Cohen SA, Mauri L. Carotid artery stenting with emboli protection surveillance study: thirty-day results of the CASES-PMS study. Catheter Cardiovasc Interv 2007; 70:316–323.
47 Theiss W, Hermanek P, Mathias K, Ahmadi R, Heuser L, Hoffmann FJ, Kerner R, Leisch F, Sievert H, von Sommoggy S. Pro-CAS: a prospective registry of carotid angioplasty and stenting. Stroke 2004;35:2134–2139.
48 Sidawy AN, Zwolak RM, White RA, Siami FS, Schermerhorn ML, Sicard GA. Risk-adjusted 30-day outcomes of carotid stenting and endarterectomy: results from the SVS Vascular Registry. J Vasc Surg 2009;49:71–79.
49 GrayWA, Chaturvedi S, Verta P. Thirty-day outcomes for carotid artery stenting in 6320 patients from 2 prospective, multicenter, high-surgical-risk registries. Circ Cardiovasc Interv 2009;2:159–166.
50 Rothwell PM, Giles MF, Chandratheva A, Marquardt L, Geraghty O, Redgrave JN, Lovelock CE, Binney LE, Bull LM, Cuthbertson FC, Welch SJ, Bosch S, Alexander FC, Silver LE, Gutnikov SA, Mehta Z; Early use of Existing Preventive Strategies for Stroke (EXPRESS) study. Effect of urgent treatment of transient ischaemic attack and minor stroke on early recurrent stroke (EXPRESS study): a prospective population-based sequential comparison. Lancet 2007;370:1432–1442.
51 Luengo-Fernandez R, Gray AM, Rothwell PM. Effect of urgent treatment for transient ischaemic attack and minor stroke on disability and hospital costs (EXPRESS study): a prospective population-based sequential comparison. Lancet Neurol 2009;8:235–243.
52 Naylor AR. The importance of initiating ‘best medical therapy’ and intervening as soon as possible in patients with symptomatic carotid artery disease: time for a radical rethink of practice. J Cardiovasc Surg (Torino) 2009;50:773–782.
53 Rothwell PM, Eliasziw M, Gutnikov SA, Fox AJ, Taylor DW, Mayberg MR, Warlow CP, Barnett HJ. Analysis of pooled data from the randomised controlled trials of endarterectomy for symptomatic carotid stenosis. Lancet 2003;361: 107–116.
54 Rothwell PM, Eliasziw M, Gutnikov SA, Warlow CP, Barnett HJ. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004;363:915–924.
55 Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial. Lancet 2001;357:1729–1737.
56 Mas JL, Chatellier G, Beyssen B, Branchereau A, Moulin T, Becquemin JP, Larrue V, Lievre M, Leys D, Bonneville JF, Watelet J, Pruvo JP, Albucher JF, Viguier A, Piquet P, Garnier P, Viader F, Touze E, Giroud M, Hosseini H, Pillet JC, Favrole P, Neau JP, Ducrocq X. Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Engl J Med 2006;355: 1660–1671.
57 Ederle J, Dobson J, Featherstone RL, Bonati LH, van der Worp HB, de Borst GJ, Lo TH, Gaines P, Dorman PJ, Macdonald S, Lyrer PA, Hendriks JM, McCollum C, Nederkoorn PJ, Brown MM. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis (International Carotid Stenting Study): an interim analysis of a randomised controlled trial. Lancet 2010;375: 985–997.
58 Fiehler J, Jansen O, Berger J, Eckstein HH, Ringleb PA, Stingele R. Differences in complication rates among the centres in the SPACE study. Neuroradiology 2008; 50:1049–1053.
59 Yadav JS, Wholey MH, Kuntz RE, Fayad P, Katzen BT, Mishkel GJ, Bajwa TK, Whitlow P, Strickman NE, Jaff MR, Popma JJ, Snead DB, Cutlip DE, Firth BG, Ouriel K. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med 2004;351:1493–1501.
60 Gurm HS, Yadav JS, Fayad P, Katzen BT, Mishkel GJ, Bajwa TK, Ansel G, Strickman NE, Wang H, Cohen SA, Massaro JM, Cutlip DE. Long-term results of carotid stenting versus endarterectomy in high-risk patients. N Engl J Med 2008;358:1572–1579.
61 Ederle J, Bonati LH, Dobson J, Featherstone RL, Gaines PA, Beard JD, Venables GS, Markus HS, Clifton A, Sandercock P, Brown MM. Endovascular treatment with angioplasty or stenting versus endarterectomy in patients with carotid artery stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): long-term follow-up of a randomised trial. Lancet Neurol 2009;8:898–907.
62 Ringleb PA, Allenberg J, Bruckmann H, Eckstein HH, Fraedrich G, Hartmann M, Hennerici M, Jansen O, Klein G, Kunze A, Marx P, Niederkorn K, Schmiedt W, olymosi L, Stingele R, Zeumer H, HackeW. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet 2006;368:1239–1247.
63 Eckstein HH, Ringleb P, Allenberg JR, Berger J, Fraedrich G, Hacke W, Hennerici M, Stingele R, Fiehler J, Zeumer H, Jansen O. Results of the Stent- Protected Angioplasty versus Carotid Endarterectomy (SPACE) study to treat symptomatic stenoses at 2 years: a multinational, prospective, randomised trial. Lancet Neurol 2008;7:893–902.
64 Mas JL, Chatellier G, Beyssen B. Carotid angioplasty and stenting with and without cerebral protection: clinical alert from the Endarterectomy Versus Angioplasty in Patients With Symptomatic Severe Carotid Stenosis (EVA-3S) trial. Stroke 2004;35:e18–e20.
65 Mas JL, Trinquart L, Leys D, Albucher JF, Rousseau H, Viguier A, Bossavy JP, Denis B, Piquet P, Garnier P, Viader F, Touze E, Julia P, Giroud M, Krause D, Hosseini H, Becquemin JP, Hinzelin G, Houdart E, Henon H, Neau JP, Bracard S, Onnient Y, Padovani R, Chatellier G. Endarterectomy Versus Angioplasty in Patients with Symptomatic Severe Carotid Stenosis (EVA-3S) trial: results up to 4 years from a randomised, multicentre trial. Lancet Neurol 2008; 7:885–892.
66 Economopoulos KP, Sergentanis TN, Tsivgoulis G, Mariolis AD, Stefanadis C. Carotid artery stenting versus carotid endarterectomy: a comprehensive meta-analysis of short-term and long-term outcomes. Stroke 2011;42:687–692.
67 Marquardt L, Kuker W, Chandratheva A, Geraghty O, Rothwell PM. Incidence and prognosis of ≥50% symptomatic vertebral or basilar artery stenosis: prospective population-based study. Brain 2009;132:982–988.
68 Caplan LR, Wityk RJ, Glass TA, Tapia J, Pazdera L, Chang HM, Teal P, Dashe JF, haves CJ, Breen JC, Vemmos K, Amarenco P, Tettenborn B, Leary M, Estol C, Dewitt LD, Pessin MS. New England Medical Center Posterior Circulation registry. Ann Neurol 2004;56:389–398.
69 Khan S, Cloud GC, Kerry S, Markus HS. Imaging of vertebral artery stenosis: a systematic review. J Neurol Neurosurg Psychiatry 2007;78:1218–1225.
70 Berguer R, Flynn LM, Kline RA, Caplan L. Surgical reconstruction of the extracranial vertebral artery: management and outcome. J Vasc Surg 2000;31:9–18.
71 Aboyans V, Criqui MH, McDermott MM, Allison MA, Denenberg JO, Shadman R, Fronek A. The vital prognosis of subclavian stenosis. J Am Coll Cardiol 2007;49:1540–1545.
72 Sixt S, Rastan A, Schwarzwalder U, Burgelin K, Noory E, Schwarz T, Beschorner U, Frank U, Muller C, Hauk M, Leppanen O, Hauswald K, Brantner R, Nazary T, Neumann FJ, Zeller T. Results after balloon angioplasty or stenting of atherosclerotic subclavian artery obstruction. Catheter Cardiovasc Interv 2009;73:395–403.
73 De Vries JP, Jager LC, Van den Berg JC, Overtoom TT, Ackerstaff RG, Van dePavoordt ED, Moll FL. Durability of percutaneous transluminal angioplasty for obstructive lesions of proximal subclavian artery: long-term results. J Vasc Surg 2005;41:19–23.
74 Cina CS, Safar HA, Lagana A, Arena G, Clase CM. Subclavian carotid transpositionand bypass grafting: consecutive cohort study and systematic review. J Vasc Surg 2002;35:422–429. ESC Guidelines 2899
75 Hughes K, Hamdan A, Schermerhorn M, Giordano A, Scovell S, Pomposelli F Jr. Bypass for chronic ischemia of the upper extremity: results in 20 patients. J Vasc Surg 2007;46:303–307.
76 Bakken AM, Palchik E, Saad WE, Hart JP, Singh MJ, Rhodes JM, Waldman DL, Davies MG. Outcomes of endoluminal therapy for ostial disease of the major branches of the aortic arch. Ann Vasc Surg 2008;22:388–394.
77 Lee AD, Agarwal S, Sadhu D. A 7-year experience with thoracoscopic sympathectomy for critical upper limb ischemia. World J Surg 2006;30:1644–1647.
78 Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
79 Rutherford´s Vascular Surgery. 8Th Edition. Rutherford. Jack L. Cronenwett MD, K. Wayne Jhonston. Elservier Saunders 2014.