Capítulo 7 - Isquemia Aguda
La isquemia aguda de un órgano o una extremidad se produce cuando queda privado de forma brusca del aporte sanguíneo suficiente para realizar todas sus funciones y se manifiesta por una serie de síntomas y signos que pueden variar según la localización, intensidad y tiempo de evolución de la isquemia.
7.1 Epidemiología
Es un problema relativamente infrecuente y que su incidencia ha variado con los cambios sufridos por la medicina en los últimos años (mejor diagnóstico y tratamiento de la fibrilación auricular, progresiva disminución de las valvulopatías cardiacas, mejores fármacos antiagregantes y anticoagulantes, envejecimiento de la población o aumento del número de cateterismos cardiacos,…). En la actualidad su incidencia puede estar entre 13-17 pacientes/100.000 habitantes/año y con una mortalidad aproximada del 18% (que en los mayores de 75 años alcanza el 42% en los 30 primeros días) y un 13% de tasa de amputación.
Afecta en igual proporción a hombres y mujeres. Afecta sobre todo a personas de edad media o ancianos y es excepcional en jóvenes. Cada vez se asocia menos a personas con enfermedad arterial periférica (isquemia crónica de miembros inferiores) salvo entre los sometidos a tratamiento mediante técnicas quirúrgicas o endovasculares y que pueden presentar un obstrucción aguda del injerto o la endoprótesis.
Las isquemias agudas no traumáticas en las extremidades superiores son aún mas infrecuentes (1,2-3,5 pacientes/100.000 habitantes/año) y, dadas las características de la anatomía vascular de los miembros superiores, la tasa de amputación es insignificante.
7.2 Etiología
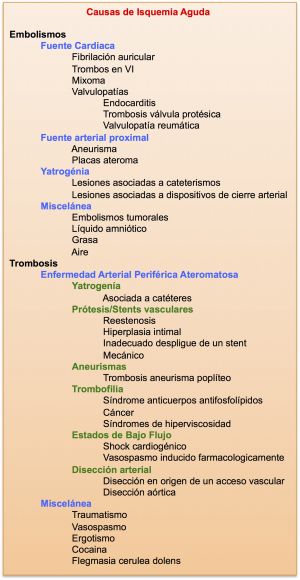
En general puede presentarse una isquemia aguda como consecuencia de una embolia, una trombosis arterial aguda o un traumatismo (este grupo lo estudiaremos en otro tema).
Desde el punto de vista topográfico, en el miembro superior, las causas de isquemia aguda son debidas a:
Embolias (suponen entre el 74-100% de las isquemia agudas de la extremidad superior en las series publicadas, se localizan principalmente en arterias axilar y humeral y en un 72% se originan en el corazón, un 12% en un vaso proximal y en el resto se desconoce la fuente embolígena). La fibrilación auricular y la disfunción ventricular son las causas más frecuentes de embolias de origen cardiaco, aunque el mixoma y los embolismos paradójicos también aparecen como causas probables. Los embolismos de origen arterial proximal pueden obstruir vasos de mediano calibre pero se manifiestan con mas frecuencia como isquemias digitales y se asocian a estenosis ateroscleróticas y aneurismas de la arteria subclavia y a ateroembolismos desde placas del cayado aórtico.
Trombosis (representan el 5% de los casos de isquemia aguda en miembros superiores y entre el 5-35% de los casos quirúrgicos). Es menos frecuente en la extremidad superior que en otros territorios y esto explica la escasa importancia estadística de esta etiología. La oclusión aguda de un aneurisma o las lesiones asociadas al síndrome de salida de tórax, arteritis, lesiones secundarias a radiación y síndromes de hipercoagulabilidad son causas de trombosis aguda.
Yatrogenia ( Representan hasta un 28% en algunas series). Se relaciona fundamentalmente con la práctica de cateterismos por vía braquial, aunque ha ido disminuyendo progresivamente en las últimas décadas.
En el miembro inferior las causas de isquemia aguda son:
Trombosis (85% de los casos) es la causa fundamental y su porcentaje ha aumentado a medida que disminuía el de embolias. Se asocian a trombosis espontánea de arteria nativa (30%) y el resto estáasociado a trombosis de vasos tras un procedimiento quirúrgico o endovascular (70%). Es importante señalar la trombosis de un aneurisma poplíteo como otra de las causas importantes de isquemia aguda y se asocia a un 14% de amputaciones. Solo un 10% de casos se asocia a yatrogenia, traumatismos, disección o vasculitis.
Embolias. Representan actualmente menos del 15% de los casos de isquemia aguda en miembros inferiores, están producidas mas por fibrilación auricular y disfunción ventricular, y cada vez menos por valvulopatías cardíacas. Los embolismos originados en arterias proximales tiene escasa relevancia. Otras causas menos prevalentes son las endocarditis bacterianas, mixoma cardíaco, y embolismos paradójicos por permeabilidad del foramen oval.
Yatrogenia. Prácticamente asociadas a los cateterismos por vía femoral que producen lesión directa de la arteria femoral común o ilíaca, disección de la arteria y trombosis relacionada con los dispositivos de cierre arterial post-cateterismo.
Otras causas. Causas menos frecuentes son la disección de aorta, el vasospasmo intenso secundario a fármacos (ergotonina) o drogas (cocaína) y las trombosis venosas masivas (flegmasía cerúlea).
7.3 Fisiopatología
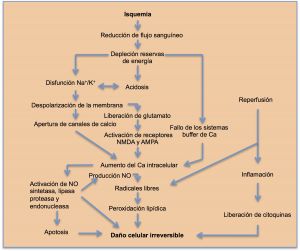
Con independencia de la causa, en la isquemia aguda se ponen en marchas complejos procesos fisiopatológicos cuyo resultado final es la acumulación de desechos tóxicos en el tejido isquémico. Estas toxinas son radicales libres, derivados del oxígeno, moléculas de elevada reactividad química que se generan tras la isquemia y posterior reperfusión.
La isquemia hace que los tejidos mal perfundidos pasen de un metabolismo aerobio a uno anaerobio, con aumento de la producción de lactado, aumento de la concentración de hidrogeniones y acidosis.
La hipoxia muscular vacía los depósitos intracelulares de ATP y, por consiguiente, la disfunción de las bombas ATPasa sodio/potasio y calcio/sodio favoreciendo la entrada del calcio intracelular. Este aumento de la concentración del calcio produce necrosis de fibras musculares al interaccionar con la actina, miosina y proteasas. A medida que se deterioran las membranas celulares musculares y la integridad de la microcirculación, los desechos celulares (potasio, fosfatos, creatinincinasa y mioglobina) se introducen en la circulación general y producen efectos colaterales a distancia que empeoran la situación clínica del enfermo. Simultáneamente, el aumento de la permeabilidad capilar con salida de plasma y proteínas provoca un edema en los tejidos afectados hasta el punto que la presión extravascular puede elevarse tanto que compite con el flujo venoso, generando un círculo vicioso que a su vez empeora el flujo arterial. Inicialmente el proceso se produce a nivel muy localizado de la microcirculación pero si la isquemia se prolonga puede afectar a segmentos importantes de la extremidad. El tejido nervioso y el muscular son muy sensibles al daño isquémico, generalmente a las 3 horas del inicio de la isquemia, y a las 6 horas el daño puede ser irreversible.
Cuando se produce la revascularización de la extremidad se pone en marcha un mecanismo conocido como síndrome de reperfusión que a su vez puede provocar lesiones dependiendo del grado de isquemia y del tiempo transcurrido desde su inicio hasta la revascularización. Este proceso pone en marcha una cascada de interacciones entre citoquinas, radicales libres y neutrófilos activados que generan daño local y sistémico provocando reacciones inflamatorias que aumentan la permeabilidad endotelial, destruyen la integridad del mismo y activan los leucocitos. La consecuencia clínica es la aparición de edema en los compartimentos musculares de las extremidades delimitados por las fascias, se produce un aumento de la presión compartimental que reduce el gradiente de perfusión capilar, pudiendo alcanzar niveles que desencadenan nuevos cuadros de isquemia muscular con la subsiguiente necrosis, eliminación de mioglobina y lesión renal y pulmonar aguda. El síndrome de reperfusión consta de dos partes: las respuesta local a la reperfusión, que se manifiesta como edema en los compartimentos musculares de la extremidad; y la respuesta sistémica capaz de desencadenar un fallo multiorgánico y muerte del enfermo.
7.4 Diagnóstico
En las isquemias agudas el diagnóstico es fundamentalmente clínico: anamnesis y exploración física.
Se suele iniciar con un cuadro de dolor y entumecimiento en la extremidad que, en casos severos, progresa a la pérdida motora y rigidez muscular.
Como regla nemotécnica recordar que se producen las 5 P: parestesias, palidez, padecimiento (dolor), pulsos ausentes y parálisis. Se podría añadir frialdad.
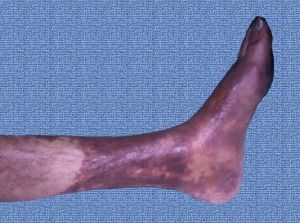
Fig. 1 Cianosis distal
La variabilidad de estos síntomas puede ser grande ya que dependen de la extensión del trombo, la circulación colateral preexistente o la arteria afectada.
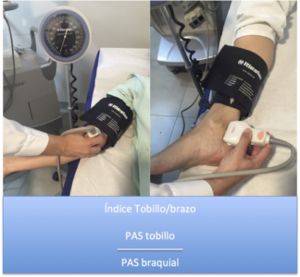
La exploración revela ausencia de pulsos palpables por debajo del segmento arterial obstruido. A veces, sobre todo si no se tiene suficiente experiencia, se pueden confundir los pulsos propios con los del paciente, por ello el uso de una sonda Doppler que nos permita documentar el flujo en las arterias de menor calibre y, especialmente, nos permita cuantificar objetivamente la disminución de flujo arterial mediante la medición del índice tobillo/brazo es útil. En condiciones normales este índice es > 1 pero disminuye a valores 0’4-0’8 en pacientes con claudicación y aún disminuye más en las isquemias con dolor de reposo o gangrena. Estos resultados pueden estar falseados en pacientes diabéticos o con insuficiencia renal porque tienen calcificaciones arterial que alteran los resultados.
Fig. 2 Índice Tobillo/Brazo
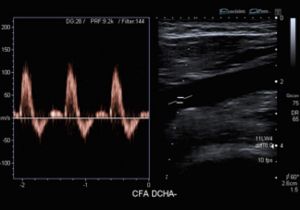
En algunos centros se recurre al Eco-Doppler para definir la extensión de la enfermedad y aunque resulta útil para definir una segmento localizado se discute su utilidad para valorar la totalidad del árbol arterial.
Fig. 3 Eco-doppler arterial normal
Hoy día, en gran número de casos, el AngioTAC y la AngioRNM con gadolinio son suficientes para el diagnóstico y, con la mejora tecnológica, es posible que puedan llegar a sustituir completamente la arteriografía. La AngioRNM es especialmente útil en pacientes con insuficiencia renal.
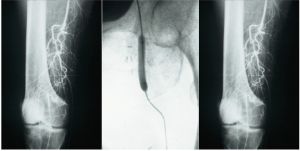
Fig. 4 AngioTAC con oclusión poplítea derecha
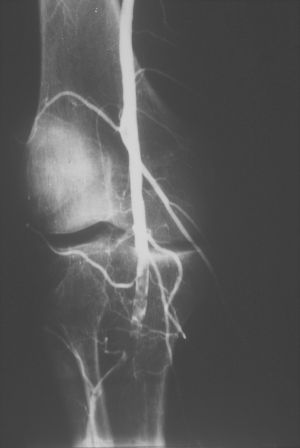
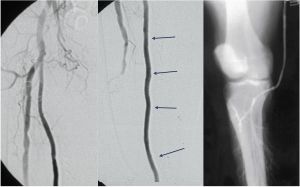
La Arteriografía sigue siendo la prueba de referencia en estos pacientes ya que aporta datos con mayor exactitud que cualquier otra técnica de imagen. Al tratarse de un método diagnóstico invasivo su uso se restringe a pacientes que van a ser intervenidos.
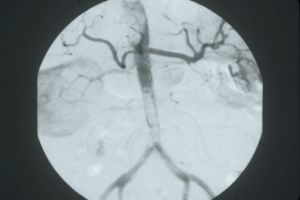
Fig. 5 Arteriografía. Embolia poplítea
En cualquier caso el uso de estas pruebas diagnósticas no debe diferir el diagnóstico y el inicio del tratamiento, especialmente en los casos clínicos 2B
ya que el tiempo siempre juega en contra del paciente.
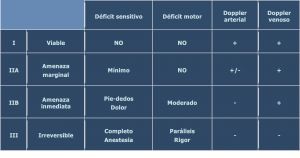
7.5 Clasificación Clínica
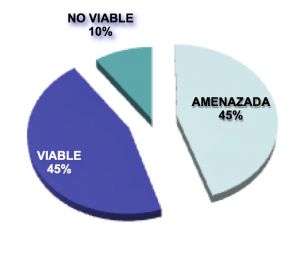
Se conoce como criterios Rutherford y establece el grado de isquemia en relación con la necesidad de tratamiento y riesgo para la extremidad:
Clase 1: la extremidad es viable aún sin ningún procedimiento terapéutico.
Clase 2: la extremidad estáamenazada si no se realiza revascularización.
2A: la amenaza no es inmediata y puede diferirse la revascularización.
2B: se precisa revascularización urgente.
Clase 3: isquemia irreversible con infarto muscular de forma que la extremidad no es rescatable y sería candidata a amputación.
Fig. 6 Clasificación clínica de Rutherford
Fig. 7 Situación de la extremidad en el momento del diagnóstico
7.6 Tratamiento
Generalmente estos paciente van a acudir a las urgencias hospitalarias dada la severidad de los síntomas.
La estrategia terapéutica va a depender de: la causa de la isquemia, la localización de la lesión, grado de Rutherford y las características específicas del paciente.
El objetivo es restablecer un flujo arterial normal lo mas rápidamente posible.
Los resultados van a depender de el retraso diagnóstico y terapéutico y las patología asociadas del paciente. Hoy día las tasas de mortalidad perioperatoria oscilan entre el 5 y el 18%.
Una vez establecido el diagnóstico, e independiente de la etiología, se debe instaurar un tratamiento inicial genérico mediante: aporte de líquidos intravenosos (IV), analgesia, administración de fármacos antitrombóticos y anticoagulantes, corrección de anomalías bioquímicas (los pacientes con CPK y neutrófilos elevados tienen un riesgo de amputación del 50% y a los pacientes con isquemia severa o irreversible se debe alcalinizar la orina para prevenir daño renal) y, si precisa, estabilización de la enfermedad subyacente.
Las medidas iniciales consistirán en anticoagulación sistémica completa con un bolo de Heparina Na ( 1.000 UI/Kg. de peso ) seguida de una perfusión continua (24.000 UI en 24 horas ), en caso de utilizar HBPM debe administrarse en dosis altas ( 100-150 UI/kg ) con el objetivo de : 1) reducir el riesgo de propagación del trombo, 2) en caso de embolia evitar la formación de un nuevo émbolo en el corazón y 3) mejorar la supervivencia. En caso de precisarse una arteriografía inmediata puede retrasarse la heparinización. Debe administrase la analgesia que sea precisa para mitigar el dolor isquémico en estos pacientes.
Simultáneamente se deben pedir estudios preoperatorios ante la posibilidad de intervención quirúrgica: hemograma, coagulación y bioquímica, EKG y Rx Tórax.
Los pacientes con isquemia aguda no solo presentan un alto riesgo de pérdida de la extremidad sino también de muerte, ya que la hipoperfusión tisular produce anomalías en los electrolitos y desequilibrio ácido-base que puede alterar la función cardiaca y pulmonar. Igualmente la reperfusión tras la cirugía puede provocar liberación de radicales libres muy tóxicos que agraven el estado del paciente.
Existen varias opciones de actuación directa sobre el émbolo o el trombo en los pacientes con isquemia aguda:
1.- Inicialmente puede tratarse solo con anticoagulación hasta estabilizar al paciente y tener un estudio completo que permita valorar otras opciones (Clase 1 y 2A).
2.- En pacientes con isquemia más severa (Clase 2B) se debe realizar un estudio de imagen precoz (preferentemente angiografía) de aorta y ambas extremidades. Con la información obtenida se puede proceder a las siguientes opciones terapéuticas:
7.6.1 Tratamientos endovasculares
7.6.1.1 Tratamiento trombolítico:
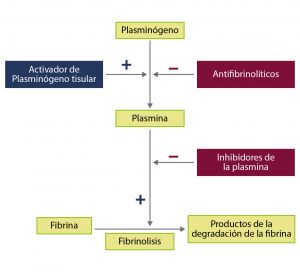
Los activadores del plasminógeno (uroquinasa, altepalsa o reteplasa) por vía intraarterial actúan mediante la conversión de plasminógeno en plasmina, que a su vez degrada la fibrina.
Fig. 8 Mecanismo fibrinólisis
Estudios aleatorios en la década de los 90 demostraron que los fibrinolíticos a través de un catéter intraarterial conseguían un 70% de repermeabiliazación de la extremidad isquémica, tasas de amputación similares a la cirugía y menor mortalidad y coste, pero presentaban mayores complicaciones hemorrágicas, incluyendo hemorragias cerebrales. Es especialmente útil para la revascularización de trombosis de injertos (bypass) y de arterias nativas con menos de 2 semanas de evolución clínica siempre y cuando el catéter de administración del fármaco pueda ser colocado intratrombo. Los pacientes diabéticos tienen peores resultados y no están indicados en pacientes que requieran revascularización inmediata. Cuando se utilizan previamente a la cirugía reducen la morbimortalidad perioperatoria.Se deben administrar asociado a heparina sódica.
7.6.1.2 Trombectomía mecánica:
Sondispositivos percutáneos que por diferentes mecanismos eliminan el trombo y que, en muchas ocasiones, se asocian a fibrinólisis. Se dividen en sistemas de aspiración y microfragmentación.
7.6.1.3 Existen otros tratamientos
de uso mas limitado como las embolectomías por aspiración o trombolisis por ultrasonidos. En casos de isquemia agudas secundarias a lesiones arteriales “in situ”, una vez eliminado el trombo, suele ser necesario tratar la lesión desencadenante.
En todos los procedimientos anteriores, si el estudio diagnóstico de imagen (el mas preciso es la angiografía) nos revela la existencia de lesiones que pueden tratarse de forma endovascular, los procedimientos mas frecuentes utilizados son las angioplastias de balón y la colocación de stent simple o recubierto.
Fig. 9 Angioplastia de balón
Fig. 10 Stents y stent recubierto endovasculares
7.6.2 Revascularización quirúrgica abierta (CAD):
Trombectomía con catéter de Fogarty, by-pass, endarterectomía,…son técnicas quirúrgicas para intentar solucionar la isquemia aguda y la lesión que las produce. Las CAD en isquemias agudas tienen una tasa de mortalidad entre el 10% y el 30% (aunque ha mejorado ligeramente en las últimas décadas para situarse en torno al 18%), además hay que añadir las complicaciones asociadas a la herida quirúrgica y a las secuelas del tiempo de
Fig. 11 Catéter Fogarty
isquemia. La tasa de mortalidad y salvación inmediata de la extremidad es similar en pacientes intervenidos y en los sometidos a fibrinólisis pero en los pacientes intervenidos se ha comprobado mayor tasa de mortalidad cardiopulmonar en el primer año tras la cirugía que los tratados con fibrinolíticos aunque la tasa de salvación de extremidad es la misma. Los resultados son peores en sector femoropoplíteo y tibial que en el aortoilíaco.
Fig. 12 By-pass femoropoplíteo con vena
No se ha encontrado diferencias en los resultados entre tratamiento quirúrgico y endovascular en las isquemias agudas clase1 y 2 de Rutherford.
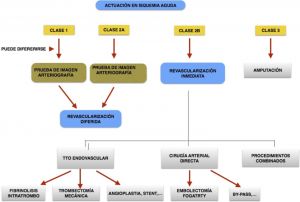
En la práctica actual la demarcación entre técnicas quirúrgicas y endovasculares suele ser borrosa y los pacientes con isquemia aguda pueden ser tratados inicialmente con trombolisis con catéter para inmediatamente ser sometidos a revascularización endovascular, cirugía abierta o combinación de ambas.
Fig. 13 Protocolo de actuación en isquemia aguda
7.7 Embolia
Del griego émbolos: tapón. Utilizado por primera vez por Virchow en 1854.
Es la obstrucción brusca de una arteria por material formado en un lugar distante y que ha emigrado a través del torrente circulatorio hasta el lugar donde produce la oclusión, generalmente una bifurcación.
Era la causa más frecuente de las isquemias agudas, aunque actualmente son las trombosis arteriales agudas. El material oclusivo puede consistir en un trombo de fibrina y plaquetas, restos de colesterol, trombo laminar aneurismático o un cuerpo extraño que ha penetrado en el torrente vascular.
La proporción de embolias arteriales es 2:1 a favor del sexo femenino. La edad media se sitúa entre los 70 y 80 años.
7.7.1 Etiología
El émbolo arterial suele ser consecuencia de una cardiopatía, de una lesión arterial proximal o una complicación de un procedimiento quirúrgico cardíaco o vascular.
El origen más común del émbolo está en el corazón izquierdo y se produce por: valvulopatía reumática (15-30%), infarto de miocardio y sus secuelas (10%) y miocardioesclerosis asociadas a alteraciones del ritmo cardiaco (fibrilación auricular 70-85%). Menor frecuencia suponen los tumores vasculares (mixomas), endocarditis, cirugía cardiaca (3-6% de ACVA post-operatorios de origen embólico)… etc. En general, el 50-60% de los pacientes que sufren una embolia estaban o habían estado los días previos en fibrilación auricular.
La existencia de aneurismas arteriales (aorta, subclavias, poplíteas,…) o placas ateromatosas extensas da lugar a la formación de trombos organizados que ocasionalmente pueden embolizar distalmente.
Otras fuentes raras de embolismos son los llamados “paradójicos”, secundarios a trombosis venosas que emigran hacia un corazón con comunicación anómala entre cavidades derechas e izquierdas, también es poco frecuente la embolia de cuerpos extraños (proyectiles, fragmentos de catéteres, prótesis…), hidátides, células tumorales,… etc.
En un 2-3% de los casos de embolias no es posible encontrar una causa aparente del embolismo.
El desarrollo de nuevas técnicas diagnósticas está cambiando la causa principal de las embolias: actualmente se conoce que el 45% de los émbolos ateromatosos son yatrógenos y la inmensa mayoría se asocian a manipulaciones angiográficas.
7.7.2 Clasificación
Pueden clasificarse según tamaño, contenido y lugar de origen.
Según tamaño:
7.7.2.1 Microembolia o Ateroembolias
La mayoría de las fuentes de microembolismos se encuentran entre la aorta infrarrenal y la bifurcación de la arteria poplítea.
Las lesiones ateroscleróticas (estenosis, placas irregulares, úlceras de pared) de aorta, ilíacas y femorales y los aneurismas poplíteos son las principales fuentes, siendo la arteria femoral común el foco principal.
Suele estar formados por material ateromatosos, cristales de colesterol o material fibrinoplaquetar.
La zona habitual de afectación son las arterias digitales.
El síndrome clínico producido por microembolismos se conoce con el nombre de microembolia aterotrombótica arterioarterial. Suele presentarse en los miembros inferiores y, según estudios en necropsias, son más frecuentes de lo esperado. En casos recidivantes pueden provocar extensas pérdidas de tejidos. La presentación típica consiste en la aparición brusca de un dedo doloroso que suele tener un color azulado, relleno capilar lento y es muy doloroso a la palpación. Puede durar desde solo unos minutos hasta varios días y ser incapacitante. Los pulsos suelen estar conservados. La evolución es muy variable.
La isquemia que se produce como consecuencia de ateroembolias es muy difícil de tratar. Por lo general, no son útiles ni la revascularización quirúrgica ni el tratamiento trombolítico, debido a la multiplicidad, composición y localización distal de los émbolos. Hay datos que sugieren que los inhibidores plaquetarios previenen las ateroembolias. Puede ser necesaria la intervención quirúrgica para eliminar o sortear el vaso ateroesclerótico o el aneurisma que produce ateroembolias recurrentes.
7.7.2.2 Macroembolia
Se deben al desprendimiento de una gran placa de ateroma o de un trombo parietal. El 80-90% proceden del corazón.
Según el origen:
Cardiaco
Inicialmente eran debidos a valvulopatía reumática pero en la actualidad un 70% se relacionan con cardiopatía aterosclerótica y un 30% con valvulopatía mitral reumática con FA. En cualquier caso esta FA existe en dos tercios de los casos de macroembolias. La segunda causa se relaciona con infarto de miocardio (20%). Los casos en que el trombo se origina en el ventrículo izquierdo se asocia solo a un 5% de las embolias. Las prótesis valvulares cardíacas son otra fuente potencial de émbolos y los trombos suelen formarse en torno al anillo de sutura. Son más frecuentes en las válvulas metálicas que precisan una anticoagulación permanente que a veces es deficiente y favorece que se forme el trombo. Los mixomas son una fuente rara de émbolos.
La formación de coágulos es más frecuente en la orejuela de una aurícula izquierda dilatada.
No cardiaco
Representan entre el 5 y 10% de los casos. Suelen proceder de lesiones ateroscleróticas de vasos proximales.
Los émbolos sobre lesiones parietales pueden producir grandes émbolos que clínicamente son indistinguibles de los de origen cardiaco.
Los aneurisma son un origen frecuente de estos émbolos (subclavias, aorta y poplíteos). Tumores no cardíacos (carcinoma pulmonar primario), cuerpos extraños que penetran en el árbol vascular o trombos paradójicos son infrecuentes.
Origen desconocido
Representan también entre el 5 y 10% de las embolias. A medida que han mejorado las técnicas diagnósticas su número ha disminuido. En estos casos se sospechan síndromes de hipercoagulabilidad, especialmente en pacientes jóvenes y en pacientes con neoplasias.
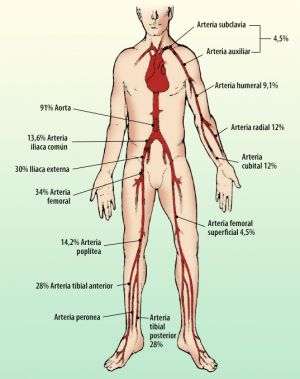
7.7.3 Localización
El destino más frecuente de los émbolos es el cerebro (60%), extremidades inferiores (30%), extremidades superiores (6%) y arterias viscerales (4%). Suelen ubicarse presentemente a nivel de las bifurcaciones. Si excluimos las embolias cerebrales la distribución sería:
Fig. 14 Distribución de embolias no cerebrales
En un 10% de los casos las embolias son múltiples y el 15% de los pacientes son reembolizaciones.
7.7.4 Fisiopatología
Cuatro fenómenos secuenciales pueden ocurrir en una embolia: oclusión arterial mecánica, vasospasmo distal de sus ramas colaterales, trombosis secundaria y alteraciones morfológicas de la pared arterial.
El territorio isquémico serátanto mayor cuanto mayor sea el segmento arterial ocluido, pero cuanto más proximal es la oclusión mayores son las posibilidades de compensación por circulación arterial colateral.
El espasmo arterial reflejo secundario a la embolia afecta no solo al vaso ocluido sino a las colaterales proximales.
El estasis sanguíneo post embólico se continúa con una trombosis secundaria; ésta puede afectar a todo el árbol arterial distal y a nivel de la microcirculación, con el consiguiente empeoramiento pronóstico (existe clara relación entre la extensión del trombo secundario y desarrollo de gangrena). El trombo secundario se desarrolla en continuidad de la zona de impacto del émbolo en el 63% de los casos y a distancia o discontinuamente en un 37%.
La presencia de un émbolo y su trombo secundario desencadenan una serie de mecanismos inflamatorios a nivel de la pared arterial: panarteritis con infiltración de células inflamatorias, disminución de la microcirculación, atrapamiento de hematíes, trombosis de los vasa vasorum, edema de la media y hemorragia intramural en la pared arterial.
El estasis sanguíneo puede desencadenar una trombosis venosa profunda hasta en un 25% de los casos.
La repentina interrupción de la irrigación en un territorio repercutiráclínicamente dependiendo del balance entre aporte y demanda de sangre, de la sensibilidad de esos tejidos frente a la hipoxia y a los cambios locales y celulares que se desencadenen.
Los nervios periféricos son los más sensibles a la hipoxia y después de 6 horas pueden producirse lesiones irreversibles.
La piel y el tejido subcutáneo son muy resistentes a la isquemia y las lesiones irreversibles pueden aparecer a veces solo tras varios días de evolución. (aspecto moteado de la piel, flictenas y necrosis).
La tolerancia muscular a la isquemia es debida a su bajo nivel metabólico durante el reposo, a sus reservas de glucógeno y a su capacidad inicial de glucólisis anaerobia. La persistencia de isquemia producirádestrucción celular y liberación de CPK, LDH , SGOT, K , radicales libres y mioglobina en orina. Finalmente el músculo se paraliza y se necrosa. Es en este momento cuando la piel también suele presentar lesiones irreversibles.
Tras la revascularización se puede producir un síndrome de reperfusión que se caracteriza por la triada de infarto muscular isquémico, mioglobinuria e insuficiencia renal secundaria a mioglobinuria. Analíticamente la mioglobinuria, la hiperpotasemia y la acidosis metabólica son las características esenciales. La insuficiencia renal se produce por necrosis tubular secundaria ya que en los túbulos renales se produce precipitación de mioglobina en condiciones de acidosis. Los efectos de la reperfusión pueden generar pérdida de la extremidad y muerte.
7.7.5 Clínica
La presentación clásica es un cuadro de aparición brusca de: dolor, palidez, frialdad, parestesias y parálisis.
La naturaleza y el carácter del dolor es variable. El dolor inicial parece deberse al impacto del émbolo sobre la pared arterial y su brusca distensión, mientras que el dolor tardío se debe a isquemia tisular y muscular. El dolor es intenso y constante.
Las parestesias, parálisis, palidez y frialdad son posteriores al dolor y su intensidad estárelación con el grado de flujo colateral y tiempo de evolución.
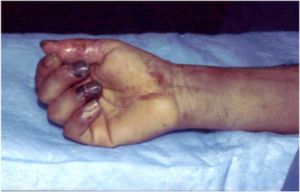
La palidez es un síntoma inicial y evoluciona tardíamente a cianosis y necrosis.
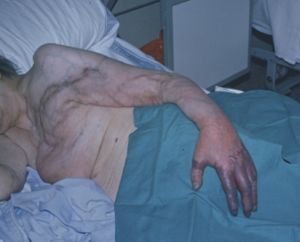
Fig. 15 Isquemia aguda severa en mano
La frialdad se sitúa por debajo de la zona obstruida y es fácil encontrar un punto de delimitación entre zonas de diferente temperatura.
La clave de la embolia arterial es el dolor de aparición brusca y desaparición de un pulso que antes se palpaba.
7.7.6 Grados de isquemia de origen embólico
1.- Isquemia moderada (Clase1), con curso atípico. Tras las horas iniciales el dolor se mitiga, el color y temperatura se normalizan, desaparece la impotencia funcional y pueden normalizarse los pulsos. Estos casos parecen deberse a una oclusión embólica parcial con fuerte vasospasmo inicial y ausencia de trombosis secundaria; o bien a un pequeño émbolo en zonas con importantes vías de circulación colateral. El resultado final del proceso es una restauración espontánea de los pulsos y ausencia de la isquemia.
2.- Isquemia avanzada (Clase2A), con peligro de gangrena y recuperación incompleta de la isquemia. Los síntomas residuales serán claudicación intermitente, neuropatía isquémica severa, contractura de Wolkmann, cambios de dolor y frialdad cutánea con zonas de gangrena cutánea superficial.
3.- Isquemia severa (Clase2B), es el tipo más frecuente. Su evolución es hacia la aparición de gangrena a los pocos días del inicio de los síntomas. Las embolizaciones múltiples, la extensión de la trombosis secundaria y el mal estado general (cardiopatías) son factores que influyen negativamente en la evolución de la embolia.
4.- Isquemia muy severa (Clase 3), resultado de una oclusión arterial con gran repercusión isquémica y afectación tisular y neurológica temprana. Puede ocurrir fallecimiento del paciente en las primeras 24 horas con resultado de embolismos viscerales o fallo cardiaco.
7.7.7 Exploración física
A la inspección apreciaremos palidez y lecho venoso distal exangüe.
A la palpación destaca la frialdad, sequedad de la piel, y ausencia de sudoración. La presión sobre dedos y masas musculares puede ser dolorosa. El signos “princeps”es la ausencia de pulsos inmediatamente por debajo de la localización del émbolo, ocasionalmente también por encima si el trombo secundario se ha propagado proximalmente.
Si intentamos que el paciente movilice la extremidad podremos apreciar la existencia de parálisis muscular (impotencia funcional) con incapacidad para mover la porción distal de la extremidad y los reflejos también se hayan disminuidos. La duración e intensidad de estos últimos son factores pronósticos muy importantes.
A la auscultación se pueden apreciar soplos (cardiopatías valvulares) o alteraciones del ritmo cardiaco (fibrilación auricular).
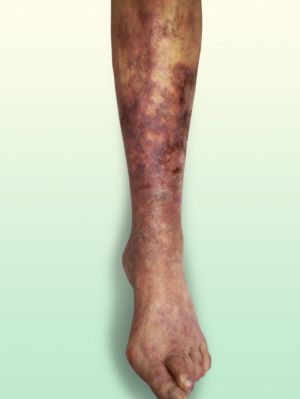
Fig. 16 Cianosis pie y pierna con isquemia aguda
7.7.8 Exploraciones complementarias
En el ECG se pueden encontrar signos de infarto de miocardio reciente o antiguo, fibrilación auricular, bloqueos aurículo-ventriculares y de insuficiencia cardiaca.
En la Rx de tórax puede no encontrarse ningún hallazgo, aunque es frecuente un aumento de la silueta cardiaca con ocasionales derrames pulmones. En aquellos casos en que la embolia se origine a partir de un aneurisma de aorta torácica o abdominal podemos apreciar calcificaciones y dilataciones de la pared de este vaso en Rx simples de tórax o abdomen. Estos hallazgos deberán ser confirmados mediante TAC.
Las analíticas sanguíneas no son significativas, solo en grandes embolias y en fases tardías pueden aparecer leucocitosis, discreta acidosis y elevación de CPK, LDH y K.
El AngioTAC, La AngioRNM con gadolinio o la arteriografía pueden resultar técnicas útiles para confirmar la embolia, su localización y su extensión o establecer un diagnóstico diferencial con otras patologías como la trombosis arterial aguda.
Fig.17 Arteriografía. Embolia término aórtica
No existe un signo patognomónico de embolia en estas técnicas de imagen, sin embargo, un árbol arterial sano con una brusca interrupción del flujo sanguíneo por una imagen de contorno redondeado y con escasa circulación colateral distal puede hacernos sospechar una embolia.
La ecocardiografía Doppler, como técnica complementaria, nos permite confirmar o descartar posible etiología cardiaca: estenosis mitral, trombos auriculares, aneurismas ventriculares post-infarto, disquinesias en la pared cardiaca,…asícomo aneurisma en subclavias, aorta abdominal, ilíacas, poplíteas,…etc. También nos permite detectar el nivel de la obstrucción arterial por el émbolo.
7.7.9 Diagnostico diferencial
Trombosis arterial aguda. Clínicamente muy parecida a una embolia, pero los pacientes con esta patología suelen tener antecedentes de claudicación intermitente, no se acompañan de alteraciones del ritmo cardiaco, en la extremidad contralateral suele faltar algún pulso y en las técnicas vasculares de imagen llaman la atención signos de ateromatosis crónica (30%). También puede presentarse en estados de hipercoagulabilidad (neoplasias, síndrome antifosfolípidos, déficit de antitrombina III, hiperhomocistinemia y vasculitis) o por oclusión de un injerto arterial (65%). La angiografía es el método de elección para realizar el diagnóstico diferencial: se aprecian alteraciones ateromatosos difusas y colateralidad desarrollada. La zona obstruida suele asociarse a una disminución irregular de la luz del vaso.
Disección aórtica. A veces debuta como una isquemia aguda de una extremidad, sin embargo se enmarca en un cuadro de crisis hipertensiva y dolor torácico o de espalda. Ocasionalmente se ausculta un soplo de insuficiencia aórtica o pueden apreciarse diferencia de pulsos entre las extremidades superiores; se diagnostica mediante angiografía, AngioRNM, AngioTAC o ecocardiografía transesofágica.
Flegmasía cerúlea dolens. Se produce generalmente por una trombosis venosa iliofemoral masiva. Se caracteriza por cianosis marcada hasta la raíz de la extremidad, pulsos presentes o algo disminuidos, edema de toda la extremidad con fóvea a la palpación y no existe impotencia funcional del pie.
Fig. 18 Flegmasía cerúlea con isquemia dedos de la mano
Síndrome de bajo flujo. Es causada por hipovolemia y bajo gasto cardiaco. Sepsis, IAM, embolismos pulmonares, deshidratación o abdomen agudo pueden desencadenarlos.
Alteraciones neurológicas. Hay que realizar el diagnóstico diferencial entre la embolia término aórtica y patologías compresivas a nivel lumbar ya que ambos cuadros manifiestan síntomas de debilidad de aparición brusca y pérdida de sensibilidad en ambas extremidades.
7.7.10 Tratamiento Preoperatorio
Debe tener un enfoque múltiple:
Protección del lecho arterial distal frente a la trombosis secundaria. Para conseguirlo es necesario la administración inmediata de un bolo de heparina Na intravenosa a dosis anticoagulantes (1 mg por Kg de peso).
Protección muscular y visceral. En casos de isquemia severa pueden ser beneficiosas la administración de soluciones hipertónicas de manitol ya que parece disminuir el edema celular y favorecer una diuresis osmótica (diuresis y alcalinización de la orina pueden evitar las complicaciones renales derivadas de la mioglobinuria).
Protección cardiaca. La integridad de la membrana celular se altera por la isquemia y se produce liberación de potasio. Debe ser corregida por reposición volémica, administración de insulina y glucosa y, en casos excepcionales, es necesario la administración de ion resíncalcio o diálisis. La producción de ácido láctico puede alterar también la función cardiaca y es necesario la administración de bicarbonato para corregir la acidosis.
Protección de la piel. Es preciso proteger la extremidad isquémica de los decúbitos, especialmente en talón y maleolos.
Protección del dolor. Hasta el momento que se solucione definitivamente la embolia hay que administrar analgésicos que mitiguen las molestias de los pacientes.
Se debe realizar un estudio preoperatorio: hemograma completo, electrolitos séricos , urea, creatinina y enzimas cardiacas y coagulación, EKG y RX de tórax.
7.7.11 Tratamiento
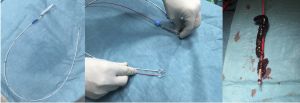
El tratamiento quirúrgico de elección es la embolectomía. Siempre que sea posible debe realizarse bajo anestesia local o loco-regional. Se monitorizaráelectrocardiográficamente al paciente, se le administraráoxígeno por medio de gafas nasales y se canalizaráuna vía venosa antebraquial. Si es preciso se añadirámedicación sedante.
La embolectomía consiste en la introducción, a través de una arteria, de un catéter con un balón inflable en la punta. Se debe introducir el catéter hasta que atraviese el émbolo y el trombo secundario en toda su extensión, posteriormente se infla el globo y se arrastra el catéter junto con el coágulo. En ocasiones se asocia a la perfusión distal de fibrinolíticos.
En los últimos años se ha introducido la fibrinolisis intrarterial con catéter y la trombolisis mecánica.
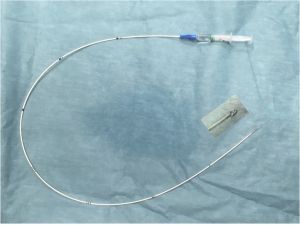
Fig. 20 Catéter de Fogarty
A la fibrinolisis intrarterial con catéter se asocia mejora en la morbimortalidad post-quirúrgica secundaría a alteraciones cardiopulmonares, pero no mejora la tasa de salvación de la extremidad y presenta complicaciones asociadas: riesgo de hemorragias, ACVA’s, alteraciones cardiopulmonares y disfunción renal.
La trombolisis mecánica percutáneas parece asociarse a buenos resultados pero no todos los dispositivos pueden utilizarse en arterias nativas y tienen un alto coste económico.
En general hoy se consigue entre un 75-90% de salvación de la extremidad con una mortalidad entre el 10 y el 20%, asociada al retraso en la revascularización y al estado general previo del paciente.
7.7.12 Evolución post- quirúrgica
Después de la revascularización se puede producir un edema importante en la extremidad que en ocasiones puede evolucionar hasta un síndrome compartimental que es preciso tratar rápidamente.
La embolectomía resuelve la isquemia aguda pero no su causa. Es importante, por tanto, mantener la anticoagulación en el post-operatorio ya que las posibilidades de reembolización son: con anticoagulación 10% y sin anticoagulación 30% tan solo en el primer mes tras la intervención.
Otro aspecto fundamental del tratamiento post-operatorio es la vigilancia y adecuado control terapéutico de la cardiopatía, ya que la mortalidad post-operatoria oscila entre el 15 y 40% y las causas más frecuentes son: insuficiencia cardiaca congestiva, insuficiencia renal aguda y embolizaciones masivas cerebrales o viscerales.
7.8 Síndrome Compartimental
Las complicaciones mas temibles en los pacientes sometidos a tratamientos de revascularización por isquemia aguda son la hemorragias cerebrales (asociadas a los tratamientos fibrinolíticos y al uso de anticoagulantes) y el síndrome compartimental.
El síndrome compartimental post reperfusión es mas frecuente en pacientes clase 2b y 3. La mortalidad de este síndrome oscila entre el 7,5% y el 40%. Se asocia estrechamente con el tiempo transcurrido entre el inicio de los síntomas y las revascularización.
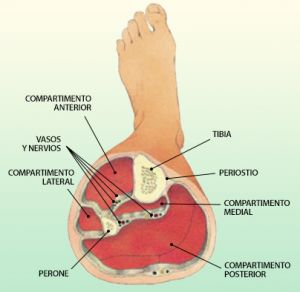
Fig. 21 Compartimentos musculares de la pierna
Se produce por edema tisular secundario al restablecimiento del flujo sanguíneo. El daño tisular producido durante el periodo de isquemia se continua tras la reperfusión por la liberación de radicales libres de oxígeno y la activación de células inflamatorias que aumentan la permeabilidad de la membrana celular y desencadenan edema muscular. Este edema muscular aumenta la presión en el espacio cerrado por las fascias musculares (compartimentos), colapsa los capilares venosos y cuando supera la presión de perfusión capilar del músculo produce una isquemia de los tejidos incluidos en dicho compartimento. A menos que se descompriman rápidamente estos tejidos se produciráuna isquemia neurovascular irreversible.
Clínicamente se manifiesta por un dolor rápido y desproporcionado y a la exploración encontraremos dolor al estiramiento pasivo de los músculos de los compartimentos afectados e hiperestesia del territorio de los afectados para evolucionar hasta edema de la extremidad, contractura muscular dolorosa y parálisis. Inicialmente los pulsos distales son palpables pero a medida que aumenta la presión compartimental pueden llegar a ser indetectables.
Fig. 22 Dispositivo para medir la presión compartimen5.tal
El diagnóstico precoz es fundamental porque una presión compartimental superior a 30 mm Hg durante 6 horas produce necrosis muscular y en numerosos casos obliga a la amputación de la extremidad.
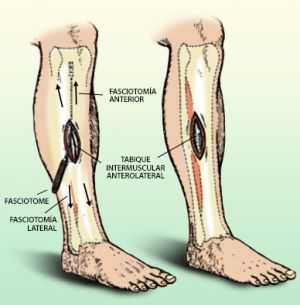
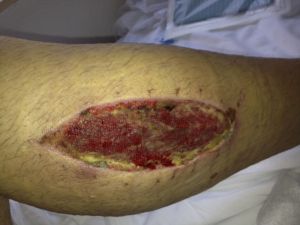
Una vez diagnosticado hay que realizar fasciotomías urgentes de los 3 compartimentos del muslo o los cuatro de la pierna. El retraso en realizarla aumenta el riesgo de rabdomiolisis, insuficiencia renal, cardiaca y muerte. Incluso con fasciotomías adecuadas la amputación puede ser necesaria en un 10-20% de los casos y en un tercio de los casos quedan secuelas funcionales en la extremidad. El síndrome de reperfusión es la principal causa de morbimortalidad tras la revascularización de una extremidad con isquemia aguda.
,
Fig. 23 Incisiones para fasciotomía en la pierna
Fig. 24 Fasciotomía abierta
7.9 Bibliografía
1. Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
2. Rutherford´s Vascular Surgery. 8Th Edition. Rutherford. Jack L. Cronenwett MD, K. Wayne Jhonston. Elservier Saunders 2014.
3. Fogarty TJ, Craneley JJ, Krause RJ, et al. A method for extration of arterial emboli and thrombi. Surg Gynecol Obstrect 116:241-244, 1963.
4. Michal Tendera (Chairperson)* (Poland),Victor Aboyans (Co-Chairperson)* (France), Marie-Louise Bartelink (TheNetherlands), Iris Baumgartner (Switzerland), Denis Cle´ment (Belgium),Jean-Philippe Collet (France), Alberto Cremonesi (Italy), Marco De Carlo (Italy),Raimund Erbel (Germany), F. Gerry R. Fowkes (UK), Magda Heras (Spain),Serge Kownator (France), Erich Minar (Austria), Jan Ostergren (Sweden),Don Poldermans (The Netherlands), Vincent Riambau (Spain), Marco Roffi(Switzerland), Joachim Ro¨ ther† (Germany), Horst Sievert (Germany), Marc van Sambeek (The Netherlands), Thomas Zeller (Germany). 06, 2001. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases. European Heart Journal 32, 2851-2906 2011.
5. Kasirajan K, Marek JM, Longsfeld M. Mechanical thrombectomy as a first-line treatment for arterial occlusion. Semin Vasc Surg. 2001;14(2):123-131.
6. The STILE Trial: results of a prospective randomized trial evaluating Surgery versus Thrombolysis for Ischemia of the Lower Extremity. Ann Surg. 1994;220:251-266.
7. Rutherford RB, Baker DJ, Ernst C, et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg. 1997;26:517-538.
8. Blaisdell FW, Steele M, Allen RE. Management of acute lower extremity arterial ischemia due to embolism and thrombosis. Surgery. 1978;84:822-834.
9. Kasirajan K, Ouriel K. Management of acute lower extremity ischemia; treatment strategies and outcomes. Curr Interv Cardiol Rep. 2000;2:119-129.
10. Campbell WB, Rider BMF, Szymanska TH. Current management of acute leg ischemia: results of audit by the Vascular Surgical Society of Great Britain and Ireland. Brit J Surg. 1999;85:1498-1503.
11. Nypaver TJ, Whyte BR, Endean ED, et al. Nontraumatic lower-extremity acute arterial ischemia. Am J Surg. 1998;176:147-152.
12. Pemberton M, Varty K, Nydahl S, et al. The surgical management of acute limb ischemia due to native vessel occlusion. Eur J Vasc Endovasc Surg. 1999;17:72-76.
13. Ouriel K, Shortell CK, DeWeese JA, et al. A comparison of thrombolytic therapy with operative revascularization in the initial treatment of acute peripheral arterial ischemia. J Vasc Surg. 1994;19:1021-1030.
14. Hopfner W, Vicol C, Bohndorf K, et al. Shredding embolectomy thrombectomy catheter for treatment of acute lower-limb ischemia. Ann Vasc Surg. 1999;13:426-435.
15. Wagner H-J, Müler-Hülsbeck S, Pitton MB, et al. Rapid thrombectomy with a hydrodynamic catheter: results from a prospective, multicenter trial. Radiology. 1997;205:675-681.
16. Silva JA, Ramee SR, Collins TJ, et al. Rheolytic thrombectomy in the treatment of acute limb-threatening ischemia: immediate results and six-month follow-up of the multicenter Angiojet registry. Cathet Cardiovasc Diagn. 1998;45:386-393.
17. Henry M, Amor M, Henry I, et al. The Hydrolyser thrombectomy catheter: a single-center experience. J Endovasc Surg. 1998;5(1):24-31.
18. Castañeda F, Smouse HB, Swischuk JL, et al. Pharmacological thrombolysis with use of the brush catheter in canine thrombosed femoropopliteal arterial PTFE bypass grafts. J Vasc Interv Radiol. 2000;11:503-508.
19. Trerotola SO, Davidson DD, Filo R, et al. Preclinical in vivo testing of a rotational mechanical thrombectomy device. J Vasc Interv Radiol. 1996;7:717-723.
20. Rilinger N, Görich J, Scharrer-Palmer R, et al. Short-term results with use of the Amplatz thrombectomy device in the treatment of acute lower limb occlusion. J Vasc Interv Radiol. 1997;8(3):343-348.
21. Sharafuddin MJ, Hicks ME, Jennson ML, et al. Rheolytic thrombectomy with the Angiojet-F105 catheter: preclinical evaluation of safety. J Vasc Interv Radiol. 1996;7:445-449.
22. Reekers JA, Kromhout JG, Spithoven HG, et al. Arterial thrombosis below the inguinal ligament: percutaneous treatment with a thrombosuction catheter. Radiology. 1996;198:49-53.
23. Tadavarthy SM, Murray PD, Inampudi S, et al. Mechanical thrombectomy with the Amplatz device: human experience. J Vasc Interv Radiol. 1994;5(5):715-724.
24. Braithwaite BD, Davies B, Birch PA, et al. Management of acute leg ischemia in the elderly. Brit J Surg. 1998;85:217-220.
25. Klonaris C, Georgopulos S, Katsargyris A, et al. Changing patterns in the etiology of the acute lower limb ischemia. Int Angiol 26:49-52, 2007.
26. Kropman RH, Schrijver AM, Kelder JC, et al. Clinical outcome of acute leg ischemia due to thrombosed popliteal artery aneurysm: systematic review of 895 cases. Eu J Vasc Endovasc Surg 39:452-457, 2010.
27. Henke PKContemporary management of acute limb ischemia: factors associated whit amputation and in-hospital mortality. Semin Vasc Surg 22:34-40, 2009.
28. Karnabatidis D, Spilopoulos S, Tsetis D et al. Quality improvement guidelines for percutaneous catheter-directed intra-arterial thrombolysis and mechanical thrombfor acute lower-limb ischemia. Cardiovasc Intervent Radiolo 34:1123-1136. 2011.
29. Ouriel K, Casteneda F, McNamara T, et al. Reptelase monotherapy and reptelase/abciximab combination therapy in peripherical arterial occlusive disease. J Vasc Interv Radiol 15:229-238, 200
30. Frink M, Hildebrand F, Krettrek C, et al. Compartment síndrome of de lower leg and foot. Clin Orthop Relat Res 468:940-950, 2010.
31. Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FGR. Inter- Society Consensus for the Management of Peripheral Arterial Disease (TASC II). J Vasc Surg 2007;45:S5–S67.
32. Sobel M, Verhaeghe R. Antithrombotic therapy for peripheral artery occlusive disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008;133:815S – 843S.
33. Results of a prospective randomized trial evaluating surgery versus thrombolysis for ischemia of the lower extremity. The STILE trial. Ann Surg 1994;220: 251 – 266.
34. Ouriel K, Veith FJ, Sasahara AA. A comparison of recombinant urokinase with vascular surgery as initial treatment for acute arterial occlusion of the legs. Thrombolysis or Peripheral Arterial Surgery (TOPAS) Investigators. N Engl J Med 1998;338:1105 – 1111.
Mensajes para llevarse a casa
1. Tasas de mortalidad y amputación altas
2. Todos los pacientes deben recibir heparina
3. Los pacientes deben ser estratificados dependiendo de la gravedad
4. La embolectomía es el método más seguro y efectivo para la embolia arterial
5. No existe ventaja de trombolisis sobre cirugía: individualizar las indicaciones
6. Trombolisis es útil para descubrir lesión causante