Capítulo 16 - Hipertensión Vásculo-Renal
El término de HTA vasculorrenal refleja la vinculación histórica entre el concepto de lesión arterial renal e hipertensión, sin embargo cada vez es más común en la literatura médica la asociación entre insuficiencia renal y lesión arterial renal, de modo que cada vez se populariza más el concepto de nefropatía isquémica que agrupa a ambas entidades. Por definición la nefropatía isquémica describe la presencia de una enfermedad obstructiva grave extra parenquimatosa de la arteria renal combinada con una insuficiencia renal excretora.
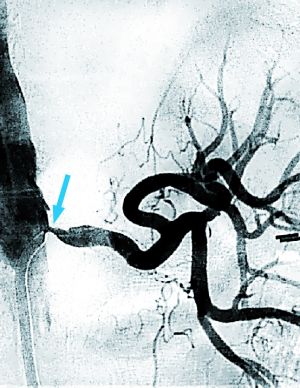
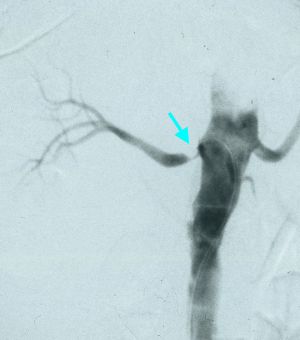
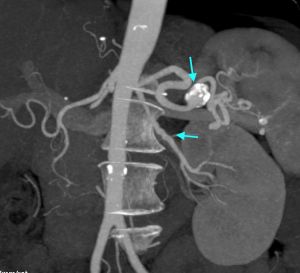
Fig. 1 Arteriografía. Estenosis en origen arteria renal
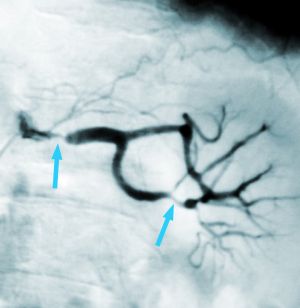
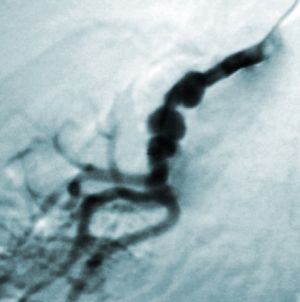
Fig. 2 Arteriografía. Múltiples estenosis en rama principal y secundaria de renal derecha
16.1 Epidemiología
Se desconoce a ciencia cierta la prevalencia de la de la insuficiencia renal o HTA asociada a enfermedad renal. El Cardiovascular Health Study estableció en una población de ancianos autónomos la presencia de un 6’8% de enfermedad vasculorrenal con repercusión hemodinámica. No parece existir relación con sexo o raza.
Se calcula que entre el 3% y 5% de la población hipertensa es por causa vasculorrenal, pero este porcentaje es mucho mayor entre los pacientes con HTA grave (diastólica>105 mm Hg). Hay mayor probabilidad de causa vasculorrenal cuando la HTA se presenta en niños o ancianos. Hay que sospechar, por tanto, HTA vasculorrenal en pacientes muy jóvenes o ancianos, con HTA de aparición brusca, HTA severa o refractaria. La sola presencia de criterios clínicos NO sirve para eliminar ningún paciente de un posible diagnóstico diferencial entre HTA esencial o vasculorrenal.
Entre el 5 y 22% de los pacientes de >50 años con insuficiencia renal avanzada tenían estenosis renal, sin embargo la HTA vasculorrenal era excepcional en la mayoría de estos pacientes. Solo el 12% de estos pacientes con IR severa y estenosis renal significativa (>90% estenosis unilateral y 50% contralateral) evolucionaron a precisar diálisis. Es más frecuente en pacientes blancos.
16.2 Etiología
Las dos principales causas de estenosis de arterias renales son: la aterosclerosis y las displasias.
Las displasias se dividen en 4 tipos: fibroplasias intimales, hiperplasia de la media, fibroplasia de la media y displasia perimedial.
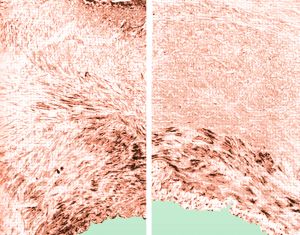
La fibroplasia de la íntima representa el 5% de todas las displasia renales, afecta sobre todo a jóvenes con estenosis tubulares irregulares, sin preferencias por sexo y de evolución lenta. En adulto se presenta en forma de lesiones focales.
Fig. 3 Fibrodisplasia de la íntima
La hiperplasia de la media representa menos del 1% de las displasias renales, su morfología es similar a la anterior, en tercio medio de la arteria renal, pero más frecuente en mujeres entre 30 y 50 años.
Fig. 4 Hiperplasia de la media
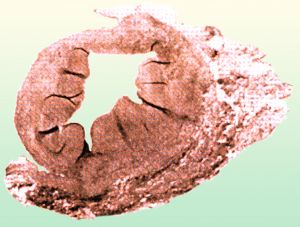
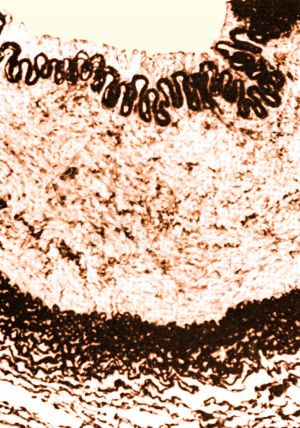
La fibrodisplasia de la media constituye el 85% de las estenosis renales displásicas. Se manifiesta sobre todo en mujeres blancas entre 30 y 40 años y en la mitad de los casos es bilateral pero en los casos unilaterales el 80% son en renal derecha. Afecta sobre todo a la arteria renal principal distal y ramas secundarias. Su aspecto es de collar de cuentas donde alternan estenosis y aneurismas.
Fig. 5 Fibrodisplasia de la media
Fig. 6 Fibrodisplasia de la media. Angiografía
La displasia perimedial supone el 10% de casos. Se presenta en mujeres jóvenes con lesiones focales o múltiples pero sin aneurismas.
Se han asociado las displasias a influencias hormonales, isquemias de la pared arterial y sobrecargas mecánicas.
Fig. 7. Displasia perimedial
16.3 Fisiopatología
La hipertensión vasculorrenal es una entidad en la que la elevación de la tensión arterial se debe a una hipoperfusión del riñón asociada a disminuciones del flujo renal. Se ha demostrado que el riñón puede adaptarse a una disminución del 30% del flujo y una caída del 40% de la presión arterial sin que la corteza y médula renal desarrollen hipoxia severa que afecte a la función renal. Sin embrago, estenosis 70-80% puede producir clara hipoxia en la cortical renal.
La estenosis renal puede afectar a un solo riñón pero, sobre todo en enfermos ateroscleróticos, puede ser bilateral y el comportamiento funcional es diferente en cada caso.
La hipoxia pone en marcha rarefacción en microvasos y activación de los mecanismos inflamatorios y oxidativos que pueden llegar a una situación irreversible en el funcionamiento renal. Los mecanismos que inducen inicialmente la subida de TA pueden considerarse en general sistemas de volumen y vasoconstricción. El estímulo inicial de la hipoperfusión activa el sistema renina angiotensina a nivel yuxtaglomerular (se libera
renina que induce aumento de angiotensina II). El sistema renina angiotensina puede actuar regulando la presión arterial y el volumen de líquido corporal, asíen la estenosis unilateral la expansión de volumen debida a la retención de Na+ provocada por la angiotensina II puede ser parcialmente contrarrestada por el riñón contralateral sano que aumenta la secreción urinaria de Na+. Este modelo se considera la principal forma de HTA por vasoconstricción. La lesión arterial bilateral elimina la natriuresis compensatoria y se produce una HTA tanto por vasoconstricción periférica como por aumento de volumen. A medio plazo se produce un aumento del gasto cardiaco inducido por la angiotensina que progresivamente es reemplazado por un aumento sostenido de la resistencia vascular periférica. A medida que la hipertensión se hace crónica adquiere mayor importancia la hipertrofia vascular y la producción de angiotensina II a nivel de células del endotelio que la hipersecreción de renina a nivel renal.
Algunos, pero no todos los pacientes, con estenosis ateroscleróticas de las arterias renales pueden tener insuficiencia renal inducida por una disminución del flujo. La insuficiencia renal, valorada por los niveles de creatinina, se produce cuando existe una amenaza a toda la masa renal, por lo que habitualmente se trata de estenosis severas que afectan a ambos riñones o estenosis en una arteria de un riñón único.
Por otro lado, la fisiopatología de la insuficiencia renal (nefropatía isquémica) no estádel todo aclarada. Posiblemente influyan los efectos paracrinos de la hipersecreción renina angiotensina donde un aumento del tono arteriolar eferente, aumento de la presión capilar glomerular y lesión túbulointersticial que favorecen un aumento de matriz extracelular y fibrosis intersticial y la consiguiente pérdida funcional de los glomérulos.
16.4 Clínica
La enfermedad isquémica renal se caracteriza por un persistente y progresivo deterioro del porcentaje de filtración glomerular y falta de evidencia de otra enfermad renal que cause dicho deterioro funcional.
Signos que sugieran la presencia de enfermedad vasculorrenal:
- HTA severa resistente al tratamiento.
- Elevación brusca de creatinina en sangre tras administración inhibidores de la enzima covertin-angiotensina (ECA) o bloqueantes del receptor de la angiotensina.
- Variabilidad significativa de la concentración de creatinina sérica.
- Episodios recurrentes de edema pulmonar agudo e insuficiencia cardiaca bruscos.
- Deterioro de la función renal tras implantar endoprótesis aórtica
Además, factores de riesgo ateroesclerótico suelen estar presentes: hiperlipemia, tabaquismo, edad >50 años. Frecuentemente coexiste también con enfermedad coronaria o arterial periférica.
16.5 Diagnóstico
La evaluación incluye una anamnesis cuidadosa, exploración física, electrolitos séricos (incluído creatinina) y electrocardiograma (EKG).
El EKG nos puede revelar el grado de hipertrofia miocárdica y posible cardiopatía asociada.
Los electrolitos seriados (especialmente niveles de K) nos permiten descartar a los aldosteronismos primarios si los niveles son superiores a 3 mEq/dl. Es fundamental determinar la funciónn renal.
Es un asunto crucial identificar métodos precisos diagnósticos de la enfermedad arterial renal. Debido al potencial daño de pruebas invasivas se recomienda testar solo a los pacientes con alto grado de sospecha:
- TA elevada de instauración reciente.
- Fracaso en tratamiento farmacológico óptimo de la HTA.
- Empeoramiento de los niveles de creatinina tras tratamiento con inhibidores del sistema renina angiotensina.
- Progresivo deterioro de función renal por enfermedad arterial renal bilateral o estenosis renal en riñón único.
- Sospecha de displasia fibromuscular en paciente joven.
- Edema agudo de pulmón e insuficiencia cardiaca bruscas recurrentes.
La prueba ideal para diagnosticar una estenosis renal es la arteriografía, pero debido a su carácter invasivo y a sus posibles complicaciones primero se debe optar por pruebas no invasivas: estas pruebas se dividen en fisiológicas y anatómicas.
Como test diagnósticos no invasivos de tipo anatómicoestarían: Eco-Doppler, AngioTAC y AngioRNM.
Si estos test son positivos estáindicada la arteriografía.
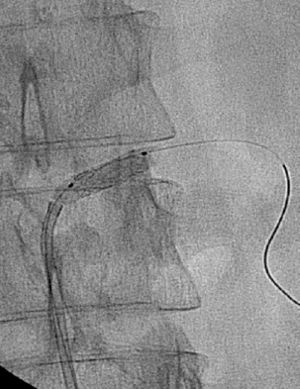
Fig. 8 Arteriografía. Estenosis crítica en el ostium de la a. renal derecha
Como estudio preliminar se acepta que el Eco-Doppler renal proporciona información funcional de las arterias renales asícomo información anatómica mediante visión directa del tronco principal de las arterias renales y medición de flujos con el Doppler. Es una prueba que solo requiere ayuno nocturno previo como preparación y no precisa la retirada de fármacos antihipertensivos. Tiene importantes desventajas: es un procedimiento largo (2 horas), es técnicamente difícil, especialmente en obesos, tiene una curva de aprendizaje larga y es explorador dependiente.
La estenosis puede ser detectada mediante valoración de la velocidad flujo sistólico en la arteria renal comparado con la aorta (cociente superior a 3.5), un aumento de la velocidad sistólica > 180-200 cm/s puede corresponder a una estenosis renal > 60%, asícomo un incremento de la velocidad final diastólica distalmente a la estenosis >150 cm/s puede suponer estenosis del 80%. Debe ser realizado en ambas arterias renales para detectar lesiones únicas o bilaterales. También es un procedimiento útil y barato para seguir la evolución de una posible estenosis. También es útil para evaluar resultados del tratamiento y diagnosticar posibles reestenosis. La sensibilidad del procedimiento es del 85% y la especificidad del 95%. Valor predictivo del 84% y falsos positivos del 8%.
El índice de resistencia renal proporciona, en manos expertas, un valor predictivo sobre el resultado de la revascularización. A mayor índice mayor grado de lesión renal y peor resultado. Una importante limitación es la existencia de arterias renales múltiples ( 17-30% ).
AngioTAC es un buen método diagnóstico para las lesiones ateroscleróticas pero no tan bueno para las displasias fibromusculares. (sensibilidad 96% y especificidad 97%). Su principal obstáculo para una buena visualización son las calcificaciones y el principal inconveniente para su realización es la necesidad de un importante volumen de contraste yodado que lo descarta en pacientes con insuficiencia renal.
Fig. 9 AngioTAC que muestra la existencia de un aneurisma esplénico y displasia en a. renal izquierda
La AngioRNM aporta magníficas imágenes de arterias renales y no hay que suspender la medicación antihipertensiva, pero el gadolinio se relaciona con complicaciones como la fibrosis sistémica nefrogénica en pacientes con función renal disminuida (sensibilidad 100% y especificidad 96%).
Todos los test no invasivos tienen peor sensibilidad y especificidad en las fibrodisplasias ya que no son adecuados para detectar lesiones en ramas de la arteria renal.
Las pruebas funcionales renales mas importantes son:
El test de renograma con captopril no es deseable como prueba inicial ya que tienen baja sensibilidad y especificad pero puede ser de ayuda para valorar la repercusión hemodinámica de la estenosis renal. Proporciona imágenes que permiten comparar el flujo y la filtración entre ambos riñones, pero es poco fiable en pacientes con estenosis bilateral o enfermedad parenquimatosa significativa (creatinina > 1.5). El protocolo contempla dos estudios, uno realizado en condiciones basales, previa suspensión de terapia antihipertensiva, y el otro bajo acción de Captopril oral (mg/kg peso, con un máximo de 75 mg). El captopril es un inhibidor de la enzima convertidora de angiotensina (ECA) que bloquea la formación de angiotensina II.
Normalmente, en presencia de estenosis de la arteria renal, el flujo sanguíneo renal se reduce lo que estimula la liberación de renina que permite la conversión de angiotensina I en angiotensina II. Esta última es un potente vasoconstrictor de la arteriola glomerular eferente, lo que permite mantener el flujo sanguíneo glomerular asícomo el gradiente de presión.
En las imágenes realizadas post-captopril, el mecanismo de compensación no estápresente, por lo que se observa una disminución del flujo sanguíneo, que se expresa en una menor captación y excreción del trazador en el riñón afectado.
Frente a una estenosis de ambas arterias renales, la interpretación del estudio es más complicada, debido a que disminuye el grado de asimetría de la respuesta en la función renal observada en el caso de estenosis unilateral. Además, se produce en este caso la coexistencia de insuficiencia renal.
Existen parámetros semicuantitativos que apoyan la interpretación cualitativa de las imágenes, tales como la función renal, el tiempo hasta el pico de captación, el comportamiento de la curva tiempo-actividad asociado a la retención a los 20 minutos, etc..
La actividad de renina en vena renal todavía se usa como prueba para detectar enfermedad arterial renal. En teoría, el nivel de renina obtenido a través de un catéter colocado en la vena renal del riñón con una estenosis renal debería mostrar niveles elevados y en el riñón contralateral disminuidos o suprimidos, pero se detectan valores elevados solo en el 50-80% de los pacientes con estenosis renal. Su nivel puede estar suprimido o disminuido en casos de dieta rica en sodio, estenosis renal bilateral, enfermedades renales intrínsecas relacionados con expansión de volumen y varias drogas antihipertensivas. Los valores de renina debería estar incrementados en los riñones con estenosis de arteria renal en comparación con el riñón sano.
Una estrategia diagnóstica aconsejable en pacientes con sospecha clínica de enfermedad arterial renal sería:
En pacientes con función renal normal es aconsejables eco-doppler, TAC o RNM como test diagnósticos aunque tienen limitaciones para valorar las estenosis en ramas de la arteria renal. Si es un paciente joven con sospecha de displasia fibromuscular debería realizarse directamente la angiografía.
La gammagrafía renal con test de captopril, medición selectiva de renina en vena renal y actividad de renina plasmática están recomendadas para valorar la posible recuperación funcional tras el tratamiento.
En pacientes con insuficiencia renal debe evaluarse la posibilidad de estenosis en aquellos con HTA de difícil control o clínica vasculorrenal: fracaso renal progresivo inexplicable, edema pulmonar e insuficiencia cardiaca recurrentes o hipertensión incontrolable.
El abordaje deseable a este problema sería:
- Si hay un experto en eco-doppler como primera opción.
- Segunda opción AngioTAC con medidas de protección renal.
E. No realizar RNM en paciente con filtración glomerular <30 ml/min y dudosa indicación entre 30 y 60 ml/min.
Si los resultados muestran estenosis >75% uni o bilateral o 50% con dilatación post estenótica sugieren posible hipertensión vasculorrenal. Estenosis <60% raramente pueden ser responsables de HTA vasculorrenal. En estudios experimentales en humanos se ha demostrado que para producir elevación de renina es necesario un gradiente de presión antes de la estenosis y posterior a la estenosis de al menos 10-20%.
El tratamiento de lesiones ateroscleróticas en hallazgos casuales no deben tratarse si no existe la certeza de ven a mejorar en control de la TA ya que puede ocurrir que la insuficiencia renal sea producida por otra enfermedad renal y la estenosis tan solo sea un hallazgo incidental.
16.6 Diagnóstico Diferencial
Hay dos cuadros con clínica similar pero que no se benefician de la revascularización: nefroesclerosis hipertensiva y el ateroembolismo renal.
La nefroesclerosis hipertensiva se manifiesta por HTA, deterioro lento y progresivo de la función renal, un sedimento de orina anodino y posible evidencia de enfermedad aterosclerótica.
La enfermedad ateroembólica puede precipitarse por manipulación aórtica u ocurrir espontáneamente. Se diferencia de las dos entidades anteriores por un brusco deterioro de la función renal. Evidencia de microembolismos extra renales y la presencia transitorio de hipocomplementinemia, eosinofilia y/o eosinofiluria. En este caso la angiografía estácontraindicada por riesgo de empeorar la situación.
La nefropatía isquémica puede incluir de forma amplia la necrosis tubular aguda, obstrucción arterial intrarrenal o capilar debida a vasculitis, alteraciones hemolíticas o coagulopatías (microangiopatía trombótica o la enfermedad en células en hoz) y enfermedades por inmunodepósitos (glomerulonefritis). Habitualmente se utiliza este término para referirse al IR secundaria a estenosis de la arteria renal o sus ramas extra renales, generalmente de origen aterosclerótico, pero hay que establecer un claro diagnóstico diferencial con los procesos antes descritos ya que el pronóstico y tratamiento difieren ampliamente.
16.7 Tratamiento
Todos los pacientes con nefropatía isquémica y/o hipertensión vasculorrenal deben ser sometidos a:
Tratamiento farmacológico antihipertensivo además de cuidados rutinarios de la insuficiencia renal. Si presentan signos de enfermedad cardiovascular deben ser tratados con antiagregantes, estatinas, dejar de fumar y control de la glucemia.
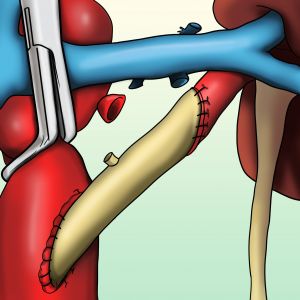
Algunos, pero no todos, pueden beneficiarse de revascularización (habitualmente angioplastia simple). En estos casos el 20-30% tendrán una recuperación funcional, un 50% mejoraran algo pero inmediatamente se estabilizaran y un 20% sufrirán un rápido deterioro de la función renal. En caso de lesiones ostiales, retracciones elásticas inmediatas, reestenosis post angioplastia o disección post-angioplastia se recomienda el uso de un stent renal. Los peores resultados se obtienen en casos de estenosis congénitas y fibrodisplasias que afectan a las ramas de la arteria renal y lesiones ateroscleróticas del ostium renal. En este último caso presenta mejores resultados anatómicos y funcionales en pacientes de riesgo moderado es la cirugía abierta (by-pass con vena safena).
Fig. 10 By-pass aorto-renal
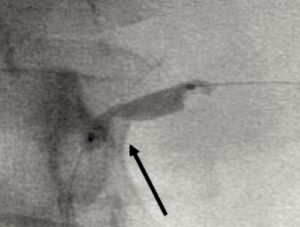
Fig. 11 Impronta de estenosis renal al dilatar el balón de angioplastia
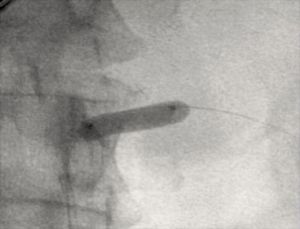
Fig. 12 Estenosis renal completamente dilatada tras angioplastia con balón
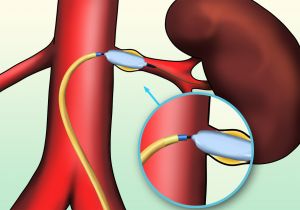
Fig. 13 Esquema angioplastia con balón
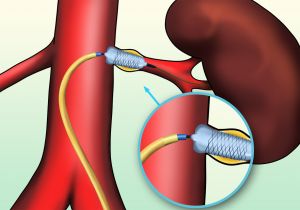
Fig. 14 Esquema de stent renal
Fig. 15 Stent renal
Los pacientes sometidos a tratamiento invasivo, si eran hipertensos, podían mejorar su hipertensión pero no mejoraba la supervivencia, mientras que en el caso de pacientes con nefropatía isquémica bilateral había un claro efecto beneficioso sobre dicha supervivencia.
16.8 Bibliografía
1. Dworkin LD, Cooper CJ. Clinical practice. Renal-artery stenosis. N Engl J Med 2009; 361:1972.
2. Textor SC, Lerman L. Renovascular hypertension and ischemic nephropathy. Am J Hypertens 2010; 23:1159.
3. Ronden RA, Houben AJ, Kessels AG, et al. Predictors of clinical outcome after stent placement in atherosclerotic renal artery stenosis: a systematic review and meta-analysis of prospective studies. J Hypertens 2010; 28:2370.
4. Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 Practice Guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease): endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation; National Heart, Lung, and Blood Institute; Society for Vascular Nursing; TransAtlantic Inter-Society Consensus; and Vascular Disease Foundation. Circulation 2006; 113:e463.
5. Echevarría JJ, Miguélez JL, López-Romero S, et al. [Arteriographic correlation in 30 patients with renal vascular disease diagnosed with multislice CT]. Radiologia 2008; 50:393.
6. Glockner JF, Vrtiska TJ. Renal MR and CT angiography: current concepts. Abdom Imaging 2007; 32:407.
7. Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
8. Cirugía Vascular. Sexta Edición. Rutherford. Elservier Saunders 2006.
9. Tumelero RT, Duda NT, Tognon AP, Thiesen M. Prevalence of renal artery stenosis in 1,656 patients who have undergone cardiac catheterization. Arq Bras Cardiol 2006;87:248–253.
10. España G, Sánchez Coll S. Hipertensión vásculo-renal. Cir Ibero-Am 1993;2: 42-46.
11. Michal Tendera (Chairperson)* (Poland), Victor Aboyans (Co-Chairperson)* (France), Marie-Louise Bartelink (The Netherlands), Iris Baumgartner (Switzerland), Denis Cle´ment (Belgium), Jean-Philippe Collet (France), Alberto Cremonesi (Italy), Marco De Carlo (Italy), Raimund Erbel (Germany), F. Gerry R. Fowkes (UK), Magda Heras (Spain), Serge Kownator (France), Erich Minar (Austria), Jan Ostergren (Sweden), Don Poldermans (The Netherlands), Vincent Riambau (Spain), Marco Roffi(Switzerland), Joachim Ro¨ ther† (Germany), Horst Sievert (Germany), Marc van Sambeek (The Netherlands), Thomas Zeller (Germany). 06, 2001. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases. European Heart Journal 32, 2851-2906 2011.
12. Renovascular Disease-Clinical Issues ans the management. Seminars in Vascular Surgery . 2013, 26, number 4.
13. De Bruyne B, Manoharan G, Pijls NH, Verhamme K, Madaric J, Bartunek J, Vanderheyden M, Heyndrickx GR. Assessment of renal artery stenosis severity by pressure gradient measurements. J Am Coll Cardiol 2006;48:1851–1855.
14. Gloviczki ML, Glockner JF, Lerman LO, McKusick MA, Misra S, Grande JP, Textor SC. Preserved oxygenation despite reduced blood flow in poststenotic kidneys in human atherosclerotic renal artery stenosis. Hypertension 2010;55:961–966.
15. Fatica RA, Port FK, Young EW. Incidence trends and mortality in end-stage renal disease attributed to renovascular disease in the United States. Am J Kidney Dis 2001;37:1184–1190.
16. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004;351:1296–1305.
17. Hostetter TH. Chronic kidney disease predicts cardiovascular disease. N Engl J Med 2004;351:1344–1346.
18. Wright JR, Shurrab AE, Cooper A, Kalra PR, Foley RN, Kalra PA. Left ventricular morphology and function in patients with atherosclerotic renovascular disease. J Am Soc Nephrol 2005;16:2746–2753.
19. Greco BA, Breyer JA. The natural history of renal artery stenosis: who should be evaluated for suspected ischemic nephropathy? Semin Nephrol 1996;16:2–11.
20. Zierler RE, Bergelin RO, Davidson RC, Cantwell-Gab K, Polissar NL, Strandness DE Jr. A prospective study of disease progression in patients with atherosclerotic renal artery stenosis. Am J Hypertens 1996;9:1055–1061.
21. Jaarsveld vanBC, Krijnen P, Pieterman H, Derkx FH, Deinum J, Postma CT, Dees A, Woittiez AJ, Bartelink AK, Man in’t Veld AJ, Schalekamp MA. The effect of balloon angioplasty on hypertension in atherosclerotic renal-artery stenosis. Dutch Renal Artery Stenosis Intervention Cooperative Study Group. N Engl J Med 2000;342:1007–1014.
22. Drieghe B, Madaric J, Sarno G, Manoharan G, Bartunek J, Heyndrickx GR, Pijls NH, De Bruyne B. Assessment of renal artery stenosis: side-by-side comparison of angiography and duplex ultrasound with pressure gradient measurements. Eur Heart J 2008;29:517–524.
23. AIUM practice guideline for the performance of renal artery duplex sonography. J Ultrasound Med 2009;28:120–124.
24. Zeller T, Bonvini RF, Sixt S. Color-coded duplex ultrasound for diagnosis of renal artery stenosis and as follow-up examination after revascularization. Catheter Cardiovasc Interv 2008;71:995–999.
25. Zeller T, Frank U, Spath M, Roskamm H. [Color duplex ultrasound imaging of
26. renal arteries and detection of hemodynamically relevant renal artery stenoses]. Ultraschall Med 2001;22:116–121.
27. Radermacher J, Weinkove R, Haller H. Techniques for predicting a favourable
28. response to renal angioplasty in patients with renovascular disease. Curr Opin Nephrol Hypertens 2001;10:799–805.
29. Vasbinder GB, Nelemans PJ, Kessels AG, Kroon AA, Maki JH, Leiner T, Beek FJ, Korst MB, Flobbe K, de Haan MW, van Zwam WH, Postma CT, Hunink MG, de Leeuw PW, van Engelshoven JM, Renal Artery Diagnostic Imaging Study in Hypertension (RADISH) Study Group. Accuracy of computed tomographic angiography and magnetic resonance angiography for diagnosing renal artery stenosis. Ann Intern Med 2004;141:674–682; discussion 682.
30. Kribben A, Witzke O, Hillen U, Barkhausen J, Daul AE, Erbel R. Nephrogenic systemic fibrosis: pathogenesis, diagnosis, and therapy. J Am Coll Cardiol 2009; 53:1621–1628.
31. Kapoor N, Fahsah I, Karim R, Jevans AJ, Leesar MA. Physiological assessment of renal artery stenosis: comparisons of resting with hyperemic renal pressure measurements. Catheter Cardiovasc Interv 2010;76:726–732.
32. Mangiacapra F, Trana C, Sarno G, Davidavicius G, Protasiewicz M, Muller O, Ntalianis A, Misonis N, Van Vlem B, Heyndrickx GR, De Bruyne B. Translesional pressure gradients to predict blood pressure response after renal artery stenting in patients with renovascular hypertension. Circ Cardiovasc Interv 2010;3:537–542.
33. Jaarsveld vanBC, Krijnen P, Derkx FH, Oei HY, Postma CT, Schalekamp MA. The place of renal scintigraphy in the diagnosis of renal artery stenosis. Fifteen years of clinical experience. Arch Intern Med 1997;157:1226–1234.
34. Mailloux LU, Napolitano B, Bellucci AG, Vernace M, Wilkes BM, Mossey RT. Renal vascular disease causing end-stage renal disease, incidence, clinical correlates, and outcomes: a 20-year clinical experience. Am J Kidney Dis 1994;24:622–629.
35. Zeller T, Muller C, Frank U, Burgelin K, Schwarzwalder U, Horn B, Roskamm H, Neumann FJ. Survival after stenting of severe atherosclerotic ostial renal artery stenoses. J Endovasc Ther 2003;10:539–545.
36. Hackam DG, Duong-Hua ML, Mamdani M, Li P, Tobe SW, Spence JD, Garg AX. Angiotensin inhibition in renovascular disease: a population-based cohort study. Am Heart J 2008;156:549–555.
37. Plouin PF. Stable patients with atherosclerotic renal artery stenosis should be treated first with medical management. Am J Kidney Dis 2003;42:851–857.
38. Webster J, Marshall F, Abdalla M, Dominiczak A, Edwards R, Isles CG, Loose H, Main J, Padfield P, Russell IT, Walker B, Watson M, Wilkinson R. Randomised comparison of percutaneous angioplasty vs continued medical therapy for hypertensive patients with atheromatous renal artery stenosis. Scottish and Newcastle Renal Artery Stenosis Collaborative Group. J Hum Hypertens 1998; 12:329–335.
39. Nordmann AJ, Logan AG. Balloon angioplasty versus medical therapy for hypertensive patients with renal artery obstruction. Cochrane Database Syst Rev 2003;3: CD002944.
40. Balk E, Raman G, Chung M, Ip S, Tatsioni A, Alonso A, Chew P, Gilbert SJ, Lau J. Effectiveness of management strategies for renal artery stenosis: a systematic review. Ann Intern Med 2006;145:901–912.
41. Gray BH, Olin JW, Childs MB, Sullivan TM, Bacharach JM. Clinical benefit of renal artery angioplasty with stenting for the control of recurrent and refractory congestive heart failure. Vasc Med 2002;7:275–279.
42. Kane GC, Xu N, Mistrik E, Roubicek T, Stanson AW, Garovic VD. Renal artery
43. revascularization improves heart failure control in patients with atherosclerotic renal artery stenosis. Nephrol Dial Transplant 2010;25:813–820.
44. Kalra PA. Renal revascularization for heart failure in patients with atherosclerotic renovascular disease. Nephrol Dial Transplant 2010;25:661–663.
45. Plouin PF, Chatellier G, Darne B, Raynaud A. Blood pressure outcome of angioplasty in atherosclerotic renal artery stenosis: a randomized trial. Essai Multicentrique Medicaments vs Angioplastie (EMMA) Study Group. Hypertension 1998; 31:823–829.
46. Nordmann AJ, Woo K, Parkes R, Logan AG. Balloon angioplasty or medical therapy for hypertensive patients with atherosclerotic renal artery stenosis? A meta-analysis of randomized controlled trials. Am J Med 2003;114:44–50.
47. Wheatley K, Ives N, Gray R, Kalra PA, Moss JG, Baigent C, Carr S, Chalmers N, Eadington D, Hamilton G, Lipkin G, Nicholson A, Scoble J. Revascularization versus medical therapy for renal-artery stenosis. N Engl J Med 2009;361:1953–1962.
48. Bax L, Woittiez AJ, Kouwenberg HJ, Mali WP, Buskens E, Beek FJ, Braam B, Huysmans FT, Schultze Kool LJ, Rutten MJ, Doorenbos CJ, Aarts JC, Rabelink TJ, Plouin PF, Raynaud A, van Montfrans GA, Reekers JA, van den Meiracker AH, Pattynama PM, van de Ven PJ, Vroegindeweij D, Kroon AA, de Haan MW, Postma CT, Beutler JJ. Stent placement in patients with atherosclerotic renal artery stenosis and impaired renal function: a randomized trial. Ann Intern Med 2009;150:840–848, W150–W841.
49. Kalra PA, Chrysochou C, Green D, Cheung CM, Khavandi K, Sixt S, Rastan A, Zeller T. The benefit of renal artery stenting in patients with atheromatous renovascular disease and advanced chronic kidney disease. Catheter Cardiovasc Interv 2010;75:1–10.
50. Krishnamurthi V, Novick AC, Myles JL. Atheroembolic renal disease: effect on
51. morbidity and survival after revascularization for atherosclerotic renal artery stenosis. J Urol 1999;161:1093–1096.
52. Scolari F, Tardanico R, Zani R, Pola A, Viola BF, Movilli E, Maiorca R. Cholesterol crystal embolism: a recognizable cause of renal disease. Am J Kidney Dis 2000;36:1089–1109.
53. Cooper CJ, Haller ST, Colyer W, Steffes M, Burket MW, Thomas WJ, Safian R, Reddy B, Brewster P, Ankenbrandt MA, Virmani R, Dippel E, Rocha-Singh K, Murphy TP, Kennedy DJ, Shapiro JI, D’Agostino RD, Pencina MJ, Khuder S. Embolic protection and platelet inhibition during renal artery stenting. Circulation 2008;117:2752–2760.
54. Symonides B, Chodakowska J, Januszewicz A, Lapinski M, Januszewicz M, Rowinski O, Szmidt J, Kuch-Wocial A, Kurzyna M, Malek G, Berent H, Zeller T, Rastan A, Schwarzwalder U, Muller C, Frank U, Burgelin K, Sixt S, Schwarz T, Noory E, Neumann FJ. Regression of left ventricular hypertrophy following stenting of renal artery stenosis. J Endovasc Ther 2007;14:189–197.
55. Schwarzwalder U, Hauk M, Zeller T. RADAR—a randomised, multi-centre, prospective study comparing best medical treatment versus best medical treatment plus renal artery stenting in patients with haemodynamically relevant atherosclerotic renal artery stenosis. Trials 2009;10:60.
56. Sos TA, Pickering TG, Sniderman K, Saddekni S, Case DB, Silane MF, Vaughan ED Jr, Laragh JH. Percutaneous transluminal renal angioplasty in renovascular hypertension due to atheroma or fibromuscular dysplasia. N Engl J Med 1983;309:274–279.
57. Slovut DP, Olin JW. Fibromuscular dysplasia. N Engl J Med 2004;350:1862–1871.
58. Davies MG, Saad WE, Peden EK, Mohiuddin IT, Naoum JJ, Lumsden AB. The long-term outcomes of percutaneous therapy for renal artery fibromuscular dysplasia. J Vasc Surg 2008;48:865–871.
59. Trinquart L, Mounier-Vehier C, Sapoval M, Gagnon N, Plouin PF. Efficacy of revascularization for renal artery stenosis caused by fibromuscular dysplasia: a systematic review and meta-analysis. Hypertension 2010;56:525–532.
60. Rastan A, Krankenberg H, Muller-Hulsbeck S, Sixt S, Tubler T, Muller C, Schwarzwalder U, Frank U, Schwarz T, Leppaenen O, Neumann FJ, Zeller T. Improved renal function and blood pressure control following renal artery angioplasty: the renal artery angioplasty in patients with renal insufficiency and hypertension using a dedicated renal stent device study (PRECISION). EuroIntervention 2008;4:208–213.
61. Lederman RJ, Mendelsohn FO, Santos R, Phillips HR, Stack RS, Crowley JJ. Primary renal artery stenting: characteristics and outcomes after 363 procedures. Am Heart J 2001;142:314–323.
62. Zahringer M, Sapoval M, Pattynama PM, Rabbia C, Vignali C, Maleux G, Boyer L, Szczerbo-Trojanowska M, Jaschke W, Hafsahl G, Downes M, Beregi JP, Veeger NJ, Stoll HP, Talen A. Sirolimus-eluting versus bare-metal low-profile stent for renal artery treatment (GREAT Trial): angiographic follow-up after 6 months and clinical outcome up to 2 years. J Endovasc Ther 2007;14:460–468.
63. Misra S, Thatipelli MR, Howe PW, Hunt C, Mathew V, Barsness GW, Pflueger A, Textor SC, Bjarnason H, McKusick MA. Preliminary study of the use of drug-eluting stents in atherosclerotic renal artery stenoses 4 mm in diameter or smaller. J Vasc Interv Radiol 2008;19:833–839.
64. Zeller T, Rastan A, Schwarzwalder U, Mueller C, Schwarz T, Frank U, Burgelin K, Sixt S, Noory E, Beschorner U, Hauswald K, Branzan D, Neumann FJ. Treatment of instent restenosis following stent-supported renal artery angioplasty. Catheter Cardiovasc Interv 2007;70:454–459.
65. N’Dandu ZM, Badawi RA, White CJ, Grise MA, Reilly JP, Jenkins JS, Collins TJ, Ramee SR. Optimal treatment of renal artery in-stent restenosis: repeat stent placement versus angioplasty alone. Catheter Cardiovasc Interv 2008;71:701–705.
66. Patel PM, Eisenberg J, Islam MA, Maree AO, Rosenfield KA. Percutaneous revascularization of persistent renal artery in-stent restenosis. Vasc Med 2009;14:259–264.
67. Davies MG, SaadWA, Bismuth JX, Peden EK, Naoum JJ, Lumsden AB. Outcomes of endoluminal reintervention for restenosis after percutaneous renal angioplasty and stenting. J Vasc Surg 2009;49:946–952.
68. Senekowitsch C, Assadian A, Wlk MV, Assadian O, Ptakovsky H, Hagmuller GW. Renal artery surgery in the era of endovascular intervention. Vasa 2004;33:226–230.
69. Balzer KM, Pfeiffer T, Rossbach S, Voiculescu A, Modder U, Godehardt E,
70. Sandmann W. Prospective randomized trial of operative vs interventional treatment for renal artery ostial occlusive disease (RAOOD). J Vasc Surg 2009;49:667–674; discussion 674–665.
71. Zeller T, Frank U, Muller C, Burgelin K, Sinn L, Horn B, Flugel PC, Schwarzwalder U, Roskamm H, Neumann FJ. Stent-supported angioplasty of severe atherosclerotic renal artery stenosis preserves renal function and improves blood pressure control: long-term results from a prospective registry of 456 lesions. J Endovasc Ther 2004;11:95–106.
72. Zeller T, Frank U, Muller C, Burgelin K, Sinn L, Bestehorn HP, Cook-Bruns N,
73. Neumann FJ. Predictors of improved renal function after percutaneous stentsupported angioplasty of severe atherosclerotic ostial renal artery stenosis. Circulation 2003;108:2244–2249.
74. Korsakas S, Mohaupt MG, Dinkel HP, Mahler F, Do DD, Voegele J, Baumgartner I. Delay of dialysis in end-stage renal failure: prospective study on percutaneous renal artery interventions. Kidney Int 2004;65:251–258.
75. Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
76. Rutherford´s Vascular Surgery. 8Th Edition. Rutherford. Jack L. Cronenwett MD, K. Wayne Jhonston. Elservier Saunders 2014.