Capítulo 20 - Trombosis Venosa Profunda
Una trombosis venosa profunda es la presencia de un coágulo sanguíneo en una vena del sistema venoso profundo del cuerpo. El coágulo puede bloquear parcialmente o completamente el flujo de sangre a través de la vena. La mayoría de las TVP ocurren en la parte inferior de la pierna, en el muslo o la pelvis, aunque también pueden formarse en otras partes del cuerpo, incluyendo el brazo, el cerebro, los intestinos, el hígado o los riñones.
20.1 Epidemiología
En estudios realizados en autopsias se ha observado una prevalencia de TVP entre el 35 y 56%, pero es un estudio muy sesgado porque generalmente se tratan de personas muy enfermas y/o ancianos. Se calcula que la incidencia real puede ser de 1,6 personas por 1000 habitantes pero puede ascender hasta el 10,7% entre los varones mayores de 80 años.
Es algo más frecuente entre los varones que en las mujeres y en los ancianos frente a los jóvenes.
Aunque la incidencia de TEP (tromboembolismo pulmonar) ha disminuido en los últimos años existe una estrecha correlación con la presencia de TVP.
20.2 Fisiopatología
Como postuló Virchow hay que factores que influyen en el desarrollo de una TVP: 1) anomalías en el flujo sanguíneo, 2) anomalías de la sangre y 3) lesiones de la pared del vaso.
Se ha visto que las anomalías de flujo determinan la localización del trombo, las anomalías sanguíneas incluyen aberraciones de los sistemas de coagulación y fibrinólisis y que las lesiones del endotelio son más importantes que grandes traumatismos pero sin embargo la causa del trombo suele ser multifactorial.Por ejemplo, el aumento del uso de catéteres, cánulas o vías centrales tiene mucho que ver con el aumento de las TVP pero estas posibles lesiones mecánicas tienen poca o ninguna importancia en la formación de trombos venosos a otros niveles.
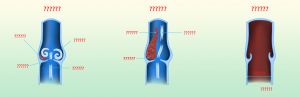
Se conoce que muchos trombos se forman en áreas de bajo flujo y se asocian además a periodos de inmovilización en lo que parece ser uno de los mecanismos desencadenantes de TVP aunque no existen pruebas claras de que el estasis sanguíneo por si mismo active los factores de coagulación. La TVP suele comenzar en las cúspides de las válvulas venosas. Los trombos están formados por trombina, fibrina y eritrocitos con una cantidad relativamente escasa de plaquetas (trombos rojos); sin tratamiento, los trombos pueden propagarse en dirección proximal o hacia los pulmones.
Fig. 1 Esquema formación trombosis
Parece ser que la activación de la cadena de coagulación es crítica para desencadenar una TVP aunque por si sola tampoco sea suficiente. Por tanto es posiblemente necesario el concurso de los tres factores para desencadenar las TVP.
Aunque durante mucho tiempo se ha considerado de forma muy estática la evolución del trombo una vez formado hoy se conoce que sufre cambios casi inmediatamente después de iniciarse, en un proceso que ha venido a llamarse de recanalización o de lisis espontánea que muchas veces acaba en la desaparición del trombo. Así, a los 6 días de la trombosis, el infiltrado neutrófilo temprano es sustituido por monocitos y su número se relaciona con aumento de la actividad endotelial, aumento de la actividad del activador del plasminógeno del tipo tisular y del tipo urocinasa en el interior del trombo. La trombolisis se caracteriza por adelgazamiento progresivo del trombo, pérdida de hebras de fibrina y desaparición de eritrocitos.
Sin que conozcamos claramente el mecanismo íntimo de recanalización parece que se forman bolsas entre el endotelio y el trombo que se agrandan progresivamente mediante una combinación de fibrinolisis, retracción del trombo y fragmentación periférica. Estas bolsas están revestidas de células planas, posiblemente derivadas del endotelio, que invaden el trombo y pueden iniciar la organización y fragmentación de zonas sueltas. El factor principal que limita la extensión de la recanalización puede ser la intensidad fibrosa de la unión entre el trombo y la pared de la vena. El resultado más frecuente es una luz venosa restaurada con engrosamiento de la íntima fibroelástica.
En los humanos la mayor reducción del trombo se produce en los tres primeros meses aunque el proceso de recanalización puede seguir durante años, aunque de forma mas lenta.
Se detectan recurrencias trombóticas segmentarias en el 50% de los pacientes, especialmente en los 40 días siguientes al proceso agudo inicial.
20.3 Factores de Riesgo
Numerosos factores pueden contribuir al desarrollo de TVP. Cuando la TVP se desarrolla en ausencia de estos factores de riesgo se conoce como primaria y si se asocia a alguno de estos factores se conoce como secundaria.
Aproximadamente el 47% de los pacientes con TVP tienen uno o más factores de riesgo.
Los principales son:
- Edad creciente
- Sexo masculino
- Cirugía
- Traumatismo
- Confinamiento en hospital o residencia
- Tumores malignos
- Enfermedades neurológicas con paresia de la extremidad
- Catéter venoso central o marcapasos
- Trombosis superficial previa
- Varices
- Enfermedades autoinmunes
- Estados hipercoagulabilidad. Trombofilias.
Entre las mujeres los factores de riesgo incluyen:
- embarazos
- anticonceptivos orales
- tratamiento hormonal sustitutivo
Los factores que predicen la recurrencia de las TVP son:
- edad avanzada
- obesidad
- neoplasias malignas
- paresia de las extremidades
Edad. Es rara en niños menores de 10 años. La posibilidad de una TVP entre a los 50 años es del 0,5% y a llega al 3,8% en los octogenarios.
Inmovilización. Se ha comprobado que en pacientes moribundos encamados se produce un 15% de TVP en la primera semana, ascendiendo hasta un 79.94% entre la segunda y doceava semana. Especial mención merece el síndrome de la clase turista, que se produce en personas que realizan largos viajes prácticamente encajonados en su asiento.
Antecedentes de TVP. Aproximadamente el 25% de los pacientes que se presentan con un cuadro agudo tenían una TVP previa. Es mayor la posibilidad en aquellos que no tienen factores de riesgo asociado. En muchos casos acaba detectándose diferentes tipos de trombofilia.
Tumores malignos. Entere el 19 y el 30% de los pacientes con una TVP tiene un cáncer no conocido. La asociación es mayor con tumores gastrointestinales productores de mucina y actualmente la mayor relación se da con tumores pulmonares. Los mecanismos trombogénicos asociados al cáncer pueden ser heterogéneos pero implican la liberación de sustancias que activan directa o indirectamente los mecanismos de trombosis. Los principales pro coagulantes tumorales conocidos son: el factor tisular, el factor pro coagulante y un activador de la proteasa cisteína o factor X. También existe relación entre tratamiento del cáncer y TVP.
Cirugía. La cirugía es un riesgo condicionado por la edad del paciente, factores de riesgo trombóticos, el tipo de intervención, la extensión del trauma quirúrgico, la duración de la intervención y de la inmovilización postoperatoria. El tipo de cirugía es muy importante ya que el riesgo general quirúrgico de TVP es del 19%, 24% en reintervenciones y entre 50-60% en intervenciones de cadera. La mayoría de estas TVP se desarrollan durante la intervención y el resto en los 5 primeros días, pero el riesgo se extiende más allá del alta ( 51% de TVP tras intervenciones ginecológicas se manifestaron tras el alta hospitalaria o el 25% de las relacionadas con cirugía abdominal)
Traumatismos. Suponen la segunda causa de TVP y el riesgo de presentarla 13 veces mayor que en la población general. En autopsias de pacientes con grandes traumatismos se ha encontrado una prevalencia del 62%. Algunos subgrupos tienen un riesgo especialmente elevado: edad, transfundidos, fractura de fémur o tibiay lesión de médula espinal.
Estados de hipercoagulabilidad primario. Suponen una mutación genética. Incluye déficit de antitrombina III, proteína C y S, resistencia a la proteína C activada (estas alteraciones están presentes en el 0’5% de los individuos sanos), hiperhomocistinemia y varios defectos potenciales de la fibrinólisis. De forma global el 42-44% de los pacientes con TVP tiene algunas de estas alteraciones. Afectan escasamente a los miembros superiores (15% ) y más en miembros inferiores.
Embarazo. La mitad de las TVP en mujeres jóvenes menores de 40 años se asocia a embarazos. Aunque se pensaba que el primer trimestre era donde más TVP se producían ahora sabemos que se distribuyen por igual durante todo el embarazo y que el mayor riesgo (2-3 veces mayor) es durante el puerperio. La TVP en el embarazo se ha atribuido a un estado pretrombótico adquirido combinado con una resistencia de salida al flujo venoso por compresión uterina. El 80-90% se detectan en miembro inferior izquierdo.
Anticonceptivos orales y terapia hormonal. Suponen el 25% de las TVP de mujeres en edad fértil y del 2% de las muertes. Aquellas que toman ACO tienen diez veces más posibilidades de enfermedad tromboembólica que las que no lo toman. El riesgo aumenta con la combinación de otros factores de riesgo como en el caso de los ACO de tercera generación que muestra sinergia con las mutaciones del factor V de Leyden y aumentan el riesgo de trombosis entre 30 y 50 veces.Se relaciona con la dosis de estrógeno y el tipo de progesterona. En casos de terapia hormonal sustitutoria, aunque las dosis de estrógenos son solo la sexta parte de los ACO, se ha comprobado un aumento de enfermedad tromboembólica de dos a cuatro veces frente a las que no lo precisan. El riesgo aparece fundamentalmente durante el primer año.
Grupo sanguíneo. Mayor riesgo los del grupo A y menor los del grupo 0. El riesgo se duplica con el consumo de ACO.
Catéteres venosos centrales. Su uso se asocia a un aumento de TVP, especialmente en miembros superiores donde el 65% se relaciona con estos dispositivos. El material del catéter, diámetro, intentos de venopunción, duración del procedimiento y composición de la sustancia a perfundir, unidos al propio traumatismo endotelial condicionan la posibilidad de TVP.
Enfermedad inflamatoria intestinal. Entre el 1 y el 7% de los pacientes con estas enfermedades pueden presentar enfermedad trombótica, especialmente en jóvenes, con enfermedad activa y en venas habitualmente inusuales (venas cerebrales).
Lupus eritematoso sistémico. Cuando se acompaña de anticuerpos antifosfolípidos es frecuente la presencia de trombosis, aborto recurrente, trombocitopenia y enfermedad neurológica. En el lupus un 34% de los enfermos tiene anticoagulante lúpico y este subgrupo tiene seis veces más posibilidades de padecer una TVP, mientras que los que presentan anticuerpos anticardiolipina (44%) tienen dos veces más posibilidades de TVP.
Varices y flebitis superficial. Parecen ser que las varices son un factor de riesgo solo en mujeres y pacientes> 65 años. Haber padecido una flebitis superficial se asocia estadísticamente a tener cuatro veces más riesgo de padecer una TVP o EP.
Otros. La obesidad, la insuficiencia cardiaca congestiva, ACV agudos se asocian tradicionalmente al riesgo de TVP pero diferentes estudios poblacionales han mostrado resultados contradictorios.
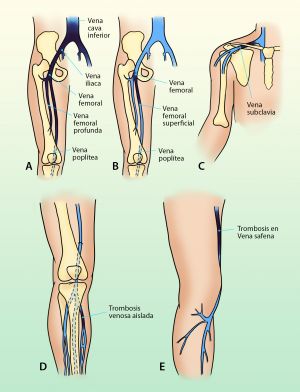
20.4 Localización
Fig. 2 Localización mas frecuente de las trombosis venosas
20.5 Clínica
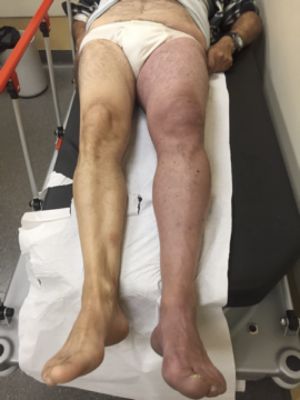
La clínica de la TVP puede variar desde la ausencia de síntomas hasta edema masivo de la extremidad con cianosis y gangrena (flegmasía cerúlea dolens). Los signos y síntomas que pueden manifestar habitualmente los pacientes con TVP aguda son dolor, edema, eritema, sensibilidad, fiebre, venas superficiales prominentes y dolor a la dorsiflexión pasiva del pie (signo de Homans). Desgraciadamente el diagnóstico basado solo en la clínica tiene muchas posibilidades de error. Solo entre el 12 y el 31% de los pacientes con sospecha de TVP y sometidos a otros estudios diagnósticos se confirma la TVP. Además la mitad de los pacientes con TVP son asintomáticos.
La exploración debe realizarse con el paciente en decúbito supino y en la inspección se debe valorar la existencia de: edema (<2 cm de diámetro de diferencia con la extremidad contralateral tiene un alto valor predictivo negativo), aumento de la circulación venosa colateral superficial, alteraciones de la coloración, cordones flebíticos o presencia de gangrena distal. A la palpación se explorarán los pulsos de toda la extremidad, si existe fóvea, si hay emplastamiento gemelar,si es doloroso a la palpación, si hay diferencias de temperatura entre las dos extremidades, y si existen adenopatías, masas pélvicas o abdominales. Se debe realizar la maniobra del signos de Homans.
Fig. 3 Flegmasía cerúlea dolens en TV iliaca
20.6 Métodos Diagnósticos
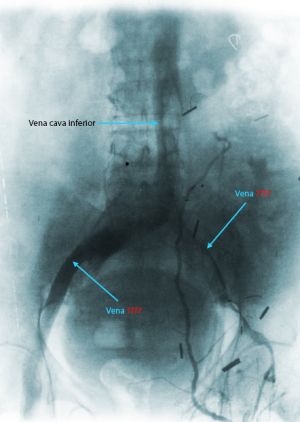
Venografía
La venografía ascendente con contraste se empleaba para confirmar el diagnóstico de TVP y durante muchos años ha sido la prueba por excelencia y tiene gran exactitud pero ciertas limitaciones: imposibilidad de canular una vena del dorso del pie, falta de visualización de algunos segmentos venosos, coste elevado, alergia a los medios de contraste, necrosis cutánea por extravasación en la zona de punción y necesidad de dotación radiológica específica. La tasa de complicación es del 3%, sobre todo debido a alergia al medio de contraste.
Fig. 4 Trombosis venos ilíaca. Flebografía
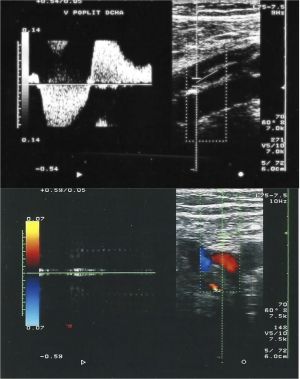
Eco-Doppler
Es una prueba incruenta, fácilmente disponible y ambulatoria. La ecografía identifica trombos mediante la visualización directa de la venas y la demostración de alteraciones en la compresibilidad de las mismas y el Doppler que permite la observación de un compromiso del flujo venoso. La prueba tiene una sensibilidad >90% y una especificidad >95% para detectar trombosis en las venas femoral y poplítea, pero es menos exacta para las venas ilíacas (errores en el 1-6% pacientes) o de la pantorrilla. Ha sustituido a la venografía y es la prueba hoy día mas utilizada.
Fig. 5 Eco-doppler
Otras pruebas de imagen
En la actualidad se evalúan alternativas no invasivas como la Angioresonancia magnética (RM) y el AngioTAC para evaluación de las venas pélvicas, abdominales y torácicas, en muchos casos con estudio simultaneo de la existencia de TEP (pueden proporcionar imágenes simultáneas de los trombos en las venas profundas y las arterias pulmonares subsegmentarias).
Dímero-d
El dímero-d es un subproducto de la degradación de la fibrina entrecruzada por la plasmina; el aumento de su concentración sugiere la aparición reciente y la lisis de trombos. Las pruebas para medir el dímero-d tienen sensibilidades y especificidades variables, aunque la mayoría es sensible (96,8%) pero inespecífica (35,2%). Por lo tanto, una prueba negativa de dímero-d permite identificar a los pacientes con bajas probabilidades de presentar este cuadro y que no requerirían ecografía. No obstante, un resultado positivo en esta prueba es inespecífico dado que las concentraciones pueden elevarse en presencia de otras entidades (coagulación intravascular diseminada, preeclampsia, hepatopatía, traumatismo, embarazo, factor reumatoide positivo, inflamación, cirugía reciente, cáncer,…), lo que implica la necesidad de otras pruebas.
Los pacientes con aumento de la concentración de dímero-d deben someterse a una nueva ecografía algunos días más tarde. Los nuevos ensayos cualitativos en látex son muy específicos (hasta alrededor de 99%), pero hasta el momento no se indican para confirmar la TVP sin ecografía.
Determinación de la causa
Los pacientes con TVP confirmada y una causa evidente ( inmovilización, procedimiento quirúrgico, traumatismo en una pierna) no requieren otras pruebas diagnósticas. La indicación de pruebas para detectar hipercoagulabilidad es controvertida, pero a veces se solicitan en pacientes con TVP idiopática recidivante, antecedentes personales o familiares de otras trombosis y en pacientes jóvenes sin factores predisponentes evidentes. Hay evidencia que sugiere que el hallazgo de hipercoagulabilidad no predice la recidiva de la TVP tan bien como los factores de riesgo clínicos. Las pruebas de cribado para detectar cáncer en pacientes con TVP presentan un rendimiento bajo. Es probable que la evaluación selectiva guiada por una anamnesis y un examen físico completos destinada a detectar cáncer resulte acertada.<br\>
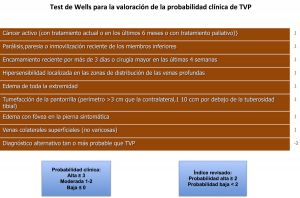
Fig. 6 Test de Wells
20.7 Diagnóstico
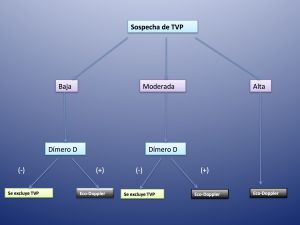
La estrategia clínica más prometedora para mejorar la exactitud diagnóstica de la TVP comprende: la anamnesis y el examen físico ayudan a determinar la probabilidad de que el paciente presente una TVP y decidir si se debe valorar el Dímero-d y finalmente la realización de un eco-doppler como prueba de confirmación en pacientes con Dímero-d positivo.
Fig. 7 Algoritmo diagnóstico de la TVP
20.8 Complicaciones
Las complicaciones más frecuentes son la insuficiencia venosa crónica, el síndrome posflebítico y la embolia pulmonar. Con menor frecuencia, la TVP aguda produce leucoflegmasia dolorosa (flegmasía alba dolens) o flegmasía cerúlea dolorosa (flegmasía cerúlea dolens), ambas responsables del desarrollo de gangrena venosa si no se diagnostican y tratan en forma oportuna. La fisiopatología es incierta, pero el edema puede aumentar la presión del tejido blando, que supera las presiones de perfusión capilares y genera isquemia tisular y gangrena húmeda. En la flegmasía cerúlea dolens, una trombosis iliofemoral masiva provoca una oclusión venosa casi completa; la pierna experimenta isquemia, dolor intenso y cianosis. La fisiopatología puede caracterizarse por estasis completo del flujo sanguíneo venoso y arterial en el miembro inferior debido a la obstrucción del retorno venoso o a edema masivo que detiene el flujo sanguíneo arterial. También puede producirse una gangrena venosa. Rara vez, los coágulos venosos pueden infectarse. La tromboflebitis supurada de la vena yugular (síndrome de Lemierre), que es una infección bacteriana (en general anaerobia) de la vena yugular interna y los tejidos blandos circundantes, puede producirse tras una faringoamigdalitis y a menudo se complica con bacteriemia y sepsis. En la tromboflebitis pelviana séptica se producen trombosis pelvianas posparto, que luego se infectan y causan fiebre intermitente. La tromboflebitis supurada (séptica), una infección bacteriana de una vena periférica superficial, suele producirse tras la colocación de un catéter venoso.
20.9 Pronóstico
Sin tratamiento adecuado, la TVP del miembro inferior se asocia con un 10% de riesgo de embolia pulmonar mortal, mientras que en la TVP del miembro superior, la muerte es muy inusual. El riesgo de recidiva de la TVP es mínimo en pacientes con factores de riesgo transitorios (cirugías, traumatismos, inmovilidad temporaria) y máximo en pacientes con factores de riesgo persistentes (edad, insuficiencia cardíaca, cáncer), TVP idiopática o resolución incompleta de una TVP anterior (trombo residual). La concentración normal de dímero-d obtenida después de la suspensión de la administración de warfarina puede ayudar a predecir un riesgo relativamente bajo de recidiva de la TVP o la embolia pulmonar. El riesgo de insuficiencia venosa es imposible de predecir. Los factores de riesgo para el desarrollo de síndrome posflebítico son la trombosis proximal, la TVP homolateral recidivante y el índice de masa corporal (IMC) ≥ 22 kg/m2.
20.10 Tratamiento
El tratamiento está destinado principalmente a la prevención de la embolia pulmonar (las TVP no tratadas tienen un riesgo de 30-50% posibilidades de producir TEP y 10% de TEP mortales), y secundariamente al alivio de los síntomas, la prevención de la recidiva de la TVP, la insuficiencia venosa crónica y el síndrome postflebítico.
La prevención de la TVP debe dirigirse a los tres componentes de la triada de Virchow. Para los pacientes que se someten a intervenciones se debe iniciar profilaxis antitrombótica 2 horas antes de la intervención con HBPM (heparina bajo peso molecular). En los casos de cirugía de cadera o rodilla, ante el temor de riesgo hemorrágico, la profilaxis puede retrasarse hasta 10-12 horas después de la intervención.
Se ha demostrado que la compresión neumática intermitente de los miembros inferiores es útil por si sola para prevenir TVP en pacientes quirúrgicos. No tiene efectos adversos clínicos y es el método de elección en pacientes con alto riesgo hemorrágico.
La medias elásticas de compresión progresiva suponen una forma simple, segura y moderadamente eficaz de profilaxis. Se contraindican en enfermedades arteriales periféricas y se aconsejan usar de forma aislada en paciente de bajo riesgo y asociadas a otros métodos en pacientes de riesgo moderado y alto.
Fig. 8 Medias elásticas
En la actualidad el ácido acetilsalicílico y los anticoagulantes orales no se aconsejan como fármacos profilácticos.
El tratamiento de la TVP del miembro inferior y superior suele ser el mismo. Todos los pacientes con TVP deben recibir anticoagulantes, en un principio heparina (no fraccionada o de bajo peso molecular) por vía parenteral a dosis anticoagulantes y dentro de las primeras 24 o 48 horas de evolución del cuadro debe iniciarse la anticoagulación oral (dicumarínicos, xarfarina, inhibidores factor X). Esta combinación debe mantenerse durante 5 días para posteriormente seguir con anticoagulación oral. La anticoagulación inadecuada dentro de las primeras 24 horas puede aumentar el riesgo de recidiva o de embolia pulmonar.
Existe consenso actual en que la TVP aguda puede tratarse en forma ambulatoria, salvo que síntomas graves u otras enfermedades concomitantes aconsejen su ingreso. Las medidas generales sintomáticas incluyen el control del dolor con analgésicos diferentes de aspirina y antiinflamatorios no esteroides (AINE) (debido a sus efectos antiagregantes plaquetarios) y, durante períodos de inactividad, elevación de las piernas y medias de compresión fuerte.
Los pacientes pueden mantener el máximo nivel de actividad física que puedan tolerar y no hay evidencia que indique que la actividad temprana aumente el riesgo de desplazamiento del coágulo y de embolia pulmonar.
Anticoagulantes
Los anticoagulantes empleados con mayor frecuencia son los siguientes:
Heparinas de bajo peso molecular
Heparina no fraccionada
Fondaparinux
Warfarina ( derivado cumarínico )
Los efectos adversos de los anticoagulantes son principalmente hemorragias. Su riesgo aumenta en los anticoagulantes orales con valores de INR elevados. Son mas sensibles a esta complicación los ancianos y pacientes oncológicos.
Fig. 9 Pauta de tratamiento TVP
Filtro en la vena cava inferior
En aquellos pacientes en que los anticoagulantes estén contraindicados, tengan TEP recurrentes a pesar de estar correctamente anticoagulados y/o presenten trombos flotantes en venas proximales ( ilíacas o cava ) puede estar indicado la colocación de un Filtro de Vena Cava.
El filtro se coloca en la vena cava inferior justo distal a las venas renales por medio de un catéter a través de una vena yugular interna o una vena femoral. Algunos filtros en la vena cava inferior puede extraerse y son temporales. Se considera que el modelo estándar sigue siendo el filtro de Greenfield de acero inoxidable.
Los filtros reducen el riesgo de complicaciones trombóticas agudas y subaguda, pero pueden producirse otras complicaciones a más largo plazo como trombosis de cava o desplazamientos del dispositivo. Además, estos filtros pueden desplazarse u obstruirse con un coágulo. El coágulo en un filtro puede causar una congestión venosa bilateral de los miembros inferiores (incluso flegmasía cerúlea dolorosa aguda), isquemia de la mitad inferior del cuerpo e insuficiencia renal aguda. Un filtro desplazado debe extraerse bajo guía de angiografía o, si es necesario, mediante métodos quirúrgicos.
A pesar del uso generalizado de filtros en la vena cava inferior se ha demostrado cierta eficacia para prevenir la embolia pulmonar pero no para evitar la mortalidad a corto y medio plazo.
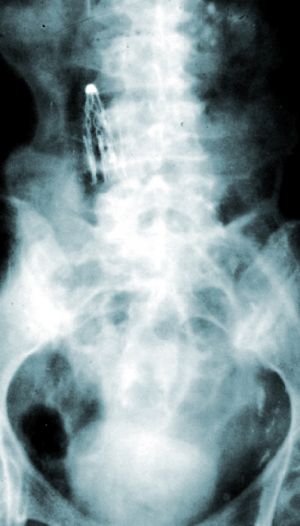
Fig. 10 Filtro de cava visto en Rx simple abdomen
Fibrinólisis
Existen pruebas de que una resolución temprana del trombo se asocia a mejores resultados con disminución de la mortalidad y menores secuelas post-trombóticas. La fibrinólisis por catéter busca mediante la perfusión directa intratrombo de fármacos la lisis precoz del trombo y la recuperación funcional valvular de la extremidad.
El mecanismo de la fibrinólisis es la activación del plasminógeno ligado a la fibrina.
Han aparecido varios estudios que apoyan resultados favorables con hasta un 80-85%, especialmente en las trombosis iliofemorales.
En el 5-10% de los casos se produjo una hemorragia mayor.
La estreptocinasa, la urocinasa y la alteplasa lisan los coágulos y parecen ser más eficaces para evitar el síndrome postflebítico en comparación con la heparina sola, aunque el riesgo de sangrado es mayor. Su aplicación se evalúa en la actualidad.
Trombectomía mecánica percutánea
Aunque se ha demostrado que la trombolisis y la trombectomía venosa tienen mejores resultados que la anticoagulación típica, la presencia de complicaciones y la imposibilidad de aplicarse a todos los casos hace que sean tratamientos marginales. Su principal indicación es la TVP iliofemoral.
Las tres desventajas principales son: posibilidad de lesionar el endotelio y las válvula venosas, fragmentación del trombo con TEP y que el procedimiento es más largo que la fibrinólisis por catéter.
Cirugía
La cirugía rara vez es necesaria. No obstante, en la flegmasía dolorosa o la flegmasía cerúlea dolorosa que no responden a trombolíticos resultafundamental llevar a cabo una trombectomía o una fasciotomía para intentar evitar una gangrena que conduzca a la pérdida del miembro.
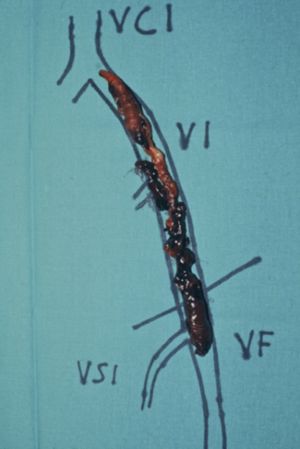
Fig. 11 Trombo venoso ilíaco extraído quirúrgicamente
20.11 Síndrome postflebítico
Es la secuela de la TVP con mayor morbilidad y coste económico a largo plazo. Tras un proceso agudo trombótico entre el 29 y el 79% de los paciente pueden presentar a largo plazo dolor, edema, hiperpigmentación o úlcera (3,7%).
Estos síntomas son consecuencia de una hipertensión venosa crónica determinada por varios factores: reflujo valvular, obstrucción venosa persistente y distribución anatómica de estas anomalías. La fisiopatología y evolución corresponden a la estudiada en el capítulo de insuficiencia venosa crónica.
No se ha encontrado una correlación clara entre las manifestaciones clínicas iniciales y la extensión de la TVP con el posterior desarrollo de un síndrome postrombótico. Parecen ser determinantes en su aparición el porcentaje de recanalización del trombo y episodios trombóticos recurrentes con repercusión final en el grado de reflujo valvular.
El tratamiento busca combatir la hipertensión venosa mediante el uso de medias elásticas compresivas, el drenaje gravitacional, la hidratación de la piel, la presoterapia y tratamientos farmacológicos específicos para la curación de úlcera.
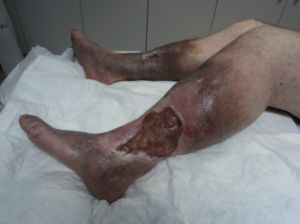
Fig. 12 Síndrome postflebítico bilateral en trombosis vena cava inferior
20.12 Bibliografía
1. Snow V, Qaseem A, Barry P, Hornbake ER, Rodnick JE, Tobolic T, et al. Management of venous thromboembolism: a clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians. Ann Intern Med. 2007 Feb 6. 146(3):204-10. [Medline].
2. Büller HR, Ten Cate-Hoek AJ, Hoes AW, Joore MA, Moons KG, Oudega R, et al. Safely ruling out deep venous thrombosis in primary care. Ann Intern Med. 2009 Feb 17. 150(4):229-35.
3. Bauersachs R, Berkowitz SD, Brenner B, Buller HR, Decousus H, Gallus AS, et al. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med. 2010 Dec 23. 363(26):2499-510.
4. Büller HR, Prins MH, Lensin AW, Decousus H, Jacobson BF, Minar E, et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med. 2012 Apr 5. 366(14):1287-97.
5. Hughes S. Rivaroxaban stands up to standard anticoagulation for VTE treatment. Medscape Medical News. Dec 13, 2012.
6. Jaff MR, McMurtry MS, Archer SL, Cushman M, Goldenberg N, Goldhaber SZ, et al. Management of Massive and Submassive Pulmonary Embolism, Iliofemoral Deep Vein Thrombosis, and Chronic Thromboembolic Pulmonary Hypertension: A Scientific Statement From the American Heart Association. Circulation. 2011 Apr 26. 123(16):1788-1830. ].
7. Silverstein MD, Heit JA, Mohr DN, Petterson TM, O'Fallon WM, Melton LJ 3rd. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Arch Intern Med. 1998 Mar 23. 158(6):585-93.
8. Useche JN, de Castro AM, Galvis GE, Mantilla RA, Ariza A. Use of US in the evaluation of patients with symptoms of deep venous thrombosis of the lower extremities. Radiographics. 2008 Oct. 28(6):1785-97.
9. Chang R, Chen CC, Kam A, Mao E, Shawker TH, Horne MK 3rd. Deep vein thrombosis of lower extremity: direct intraclot injection of alteplase once daily with systemic anticoagulation--results of pilot study. Radiology. 2008 Feb. 246(2):619-29.
10. Biuckians A, Meier GH 3rd. Treatment of symptomatic lower extremity acute deep venous thrombosis: role of mechanical thrombectomy. Vascular. 2007 Sep-Oct. 15(5):297-303.
11. Li W, Salanitri J, Tutton S, Dunkle EE, Schneider JR, Caprini JA, et al. Lower extremity deep venous thrombosis: evaluation with ferumoxytol-enhanced MR imaging and dual-contrast mechanism--preliminary experience. Radiology. 2007 Mar. 242(3):873-81.
12. Kakkos SK, Caprini JA, Geroulakos G, Nicolaides AN, Stansby GP, Reddy DJ. Combined intermittent pneumatic leg compression and pharmacological prophylaxis for prevention of venous thromboembolism in high-risk patients. Cochrane Database Syst Rev. 2008 Oct 8. CD005258.
13. Araki CT, Back TL, Padberg FT, Thompson PN, Jamil Z, Lee BC, et al. The significance of calf muscle pump function in venous ulceration. J Vasc Surg. 1994 Dec. 20(6):872-7; discussion 878-9.
14. Wakefield TW, Strieter RM, Schaub R, Myers DD, Prince MR, Wrobleski SK, et al. Venous thrombosis prophylaxis by inflammatory inhibition without anticoagulation therapy. J Vasc Surg. 2000 Feb. 31(2):309-24.
15. Wakefield TW, Proctor MC. Current status of pulmonary embolism and venous thrombosis prophylaxis. Semin Vasc Surg. 2000 Sep. 13(3):171-81.
16. GIBBS NM. Venous thrombosis of the lower limbs with particular reference to bed-rest. Br J Surg. 1957 Nov. 45(191):209-36.
17. Sevitt S. The structure and growth of valve-pocket thrombi in femoral veins. J Clin Pathol. 1974 Jul. 27(7):517-28.
18. Monreal M, Martorell A, Callejas JM, Valls R, Llamazares JF, Lafoz E, et al. Venographic assessment of deep vein thrombosis and risk of developing post-thrombotic syndrome: a prospective study. J Intern Med. 1993 Mar. 233(3):233-8.
19. Strandness DE Jr, Langlois Y, Cramer M, Randlett A, Thiele BL. Long-term sequelae of acute venous thrombosis. JAMA. 1983 Sep 9. 250(10):1289-92.
20. Prandoni P, Lensing AW, Cogo A, Cuppini S, Villalta S, Carta M, et al. The long-term clinical course of acute deep venous thrombosis. Ann Intern Med. 1996 Jul 1. 125(1):1-7.
21. Meissner MH, Caps MT, Zierler BK, Bergelin RO, Manzo RA, Strandness DE Jr. Deep venous thrombosis and superficial venous reflux. J Vasc Surg. 2000 Jul. 32(1):48-56.
22. Meissner MH, Caps MT, Zierler BK, Polissar N, Bergelin RO, Manzo RA, et al. Determinants of chronic venous disease after acute deep venous thrombosis. J Vasc Surg. 1998 Nov. 28(5):826-33.
23. Johnson BF, Manzo RA, Bergelin RO, Strandness DE Jr. Relationship between changes in the deep venous system and the development of the postthrombotic syndrome after an acute episode of lower limb deep vein thrombosis: a one- to six-year follow-up. J Vasc Surg. 1995 Feb. 21(2):307-12; discussion 313.
24. Haenen JH, Wollersheim H, Janssen MC, Van 't Hof MA, Steijlen PM, van Langen H, et al. Evolution of deep venous thrombosis: a 2-year follow-up using duplex ultrasound scan and strain-gauge plethysmography. J Vasc Surg. 2001 Oct. 34(4):649-55.
25. Andriopoulos A, Wirsing P, Bötticher R. Results of iliofemoral venous thrombectomy after acute thrombosis: report on 165 cases. J Cardiovasc Surg (Torino). 1982 Mar-Apr. 23(2):123-4.
26. Juhan C, Alimi Y, Di Mauro P, Hartung O. Surgical venous thrombectomy. Cardiovasc Surg. 1999 Oct. 7(6):586-90.
27. Saarinen J, Kallio T, Lehto M, Hiltunen S, Sisto T. The occurrence of the post-thrombotic changes after an acute deep venous thrombosis. A prospective two-year follow-up study. J Cardiovasc Surg (Torino). 2000 Jun. 41(3):441-6.
28. Kearon C. Initial treatment of venous thromboembolism. Thromb Haemost. 1999 Aug. 82(2):887-91.
29. Kakkar VV, Howes J, Sharma V, Kadziola Z. A comparative double-blind, randomised trial of a new second generation LMWH (bemiparin) and UFH in the prevention of post-operative venous thromboembolism. The Bemiparin Assessment group. Thromb Haemost. 2000 Apr. 83(4):523-9.
30. Heit JA, Mohr DN, Silverstein MD, Petterson TM, O'Fallon WM, Melton LJ 3rd. Predictors of recurrence after deep vein thrombosis and pulmonary embolism: a population-based cohort study. Arch Intern Med. 2000 Mar 27. 160(6):761-8.
31. Stein PD. Silent pulmonary embolism. Arch Intern Med. 2000 Jan 24. 160(2):145-6.
32. Lewandowski A, Syska-Suminska J, Dluzniewski M. [Pulmonary embolism suspicion in a young female patient with the Paget-von Schrötter syndrome]. Kardiol Pol. 2008 Sep. 66(9):969-71.
33. Acharya G, Singh K, Hansen JB, Kumar S, Maltau JM. Catheter-directed thrombolysis for the management of postpartum deep venous thrombosis. Acta Obstet Gynecol Scand. 2005 Feb. 84(2):155-8. ].
34. Baarslag HJ, Koopman MM, Hutten BA, Linthorst Homan MW, Büller HR, Reekers JA, et al. Long-term follow-up of patients with suspected deep vein thrombosis of the upper extremity: survival, risk factors and post-thrombotic syndrome. Eur J Intern Med. 2004 Dec. 15(8):503-507.
35. Joffe HV, Kucher N, Tapson VF, Goldhaber SZ. Upper-extremity deep vein thrombosis: a prospective registry of 592 patients. Circulation. 2004 Sep 21. 110(12):1605-11.
36. Martinelli I, Battaglioli T, Bucciarelli P, Passamonti SM, Mannucci PM. Risk factors and recurrence rate of primary deep vein thrombosis of the upper extremities. Circulation. 2004 Aug 3. 110(5):566-70.
37. Beyth RJ, Cohen AM, Landefeld CS. Long-term outcomes of deep-vein thrombosis. Arch Intern Med. 1995 May 22. 155(10):1031-7.
38. Arfvidsson B, Eklof B, Kistner RL, Masuda EM, Sato DT. Risk factors for venous thromboembolism following prolonged air travel. Coach class thrombosis. Hematol Oncol Clin North Am. 2000 Apr. 14(2):391-400, ix.
39. Ruggeri M, Tosetto A, Castaman G, Rodeghiero F. Congenital absence of the inferior vena cava: a rare risk factor for idiopathic deep-vein thrombosis. Lancet. 2001 Feb 10. 357(9254):441.
40. Hamoud S, Nitecky S, Engel A, Goldsher D, Hayek T. Hypoplasia of the inferior vena cava with azygous continuation presenting as recurrent leg deep vein thrombosis. Am J Med Sci. 2000 Jun. 319(6):414-6.
41. Greenfield LJ, Proctor MC. The percutaneous greenfield filter: outcomes and practice patterns. J Vasc Surg. 2000 Nov. 32(5):888-93.
42. Tsuji Y, Goto A, Hara I, Ataka K, Yamashita C, Okita Y, et al. Renal cell carcinoma with extension of tumor thrombus into the vena cava: surgical strategy and prognosis. J Vasc Surg. 2001 Apr. 33(4):789-96.
43. Pullen LC. PICCs may double risk for clots in critically ill patients. Medscape Medical News. May 20, 2013.
44. Chopra V, Anand S, Hickner A, Buist M, Rogers MA, Saint S, et al. Risk of venous thromboembolism associated with peripherally inserted central catheters: a systematic review and meta-analysis. Lancet. 2013 May 17.
45. Alikhan R, Cohen AT, Combe S, Samama MM, Desjardins L, Eldor A, et al. Risk factors for venous thromboembolism in hospitalized patients with acute medical illness: analysis of the MEDENOX Study. Arch Intern Med. 2004 May 10. 164(9):963-8.
46. Nordström M, Lindblad B, Bergqvist D, Kjellström T. A prospective study of the incidence of deep-vein thrombosis within a defined urban population. J Intern Med. 1992 Aug. 232(2):155-60.
47. Dahlbäck B. Inherited thrombophilia: resistance to activated protein C as a pathogenic factor of venous thromboembolism. Blood. 1995 Feb 1. 85(3):607-14.
48. Motykie GD, Caprini JA, Arcelus JI, Zebala LP, Lee CE, Finke NM, et al. Risk factor assessment in the management of patients with suspected deep venous thrombosis. Int Angiol. 2000 Mar. 19(1):47-51.
49. Motykie GD, Zebala LP, Caprini JA, Lee CE, Arcelus JI, Reyna JJ, et al. A guide to venous thromboembolism risk factor assessment. J Thromb Thrombolysis. 2000 Apr. 9(3):253-62.
50. Vandenbrouke JP, Bloemenkamp KW, Rosendaal FR, Helmerhorst FM. Incidence of venous thromboembolism in users of combined oral contraceptives. Risk is particularly high with first use of oral contraceptives. BMJ. 2000 Jan 1. 320(7226):57-8.
51. Cushman M, Tsai AW, White RH, Heckbert SR, Rosamond WD, Enright P, et al. Deep vein thrombosis and pulmonary embolism in two cohorts: the longitudinal investigation of thromboembolism etiology. Am J Med. 2004 Jul 1. 117(1):19-25.
52. Kearon C, Crowther M, Hirsh J. Management of patients with hereditary hypercoagulable disorders. Annu Rev Med. 2000. 51:169-85.
53. Prandoni P, Mannucci PM. Deep-vein thrombosis of the lower limbs: diagnosis and management. Baillieres Best Pract Res Clin Haematol. 1999 Sep. 12(3):533-54.
54. Lensing AW. Anticoagulation in acute ischaemic stroke: deep vein thrombosis prevention and long-term stroke outcomes. Blood Coagul Fibrinolysis. 1999 Aug. 10 Suppl 2:S123-7.
55. Lensing AW, Prins MH. Recurrent deep vein thrombosis and two coagulation factor gene mutations: quo vadis?. Thromb Haemost. 1999 Dec. 82(6):1564-6.
56. Deitelzweig S, Jaff MR. Medical management of venous thromboembolic disease. Tech Vasc Interv Radiol. 2004 Jun. 7(2):63-7.
57. McGarray LJ, Stokes ME, Thompson D. Outcomes of Thromboprophylaxis with enoxaparin vs. Unfractionated Heparin in Medical Inpatients: A Retrospective Database Analysis. Thromb J; 2006. Sep 27;4(1):17.
58. Cosmi B, Palareti G. D-dimer, oral anticoagulation, and venous thromboembolism recurrence. Semin Vasc Med. 2005 Nov. 5(4):365-70.
59. Linkins LA, Bates SM, Lang E, Kahn SR, Douketis JD, Julian J, et al. Selective D-dimer testing for diagnosis of a first suspected episode of deep venous thrombosis: a randomized trial. Ann Intern Med. 2013 Jan 15. 158(2):93-100.
60. Brown T. D-dimer testing best for DVT diagnosis. Available at http://www.medscape.com/viewarticle/777660. Accessed: March 19, 2013.
61. Perrier A, Desmarais S, Miron MJ, de Moerloose P, Lepage R, Slosman D, et al. Non-invasive diagnosis of venous thromboembolism in outpatients. Lancet. 1999 Jan 16. 353(9148):190-5.
62. Wells PS, Anderson DR, Rodger M, Forgie M, Kearon C, Dreyer J, et al. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis. N Engl J Med. 2003 Sep 25. 349(13):1227-35.
63. Cohen AT, Dobromirski M. The use of rivaroxaban for short- and long-term treatment of venous thromboembolism. Thromb Haemost. 2012 Jun. 107(6):1035-43.
64. Romualdi E, Donadini MP, Ageno W. Oral rivaroxaban after symptomatic venous thromboembolism: the continued treatment study (EINSTEIN-extension study). Expert Rev Cardiovasc Ther. 2011 Jul. 9(7):841-4.
65. Raskob GE, Gallus AS, Pineo GF, Chen D, Ramirez LM, Wright RT, et al. Apixaban versus enoxaparin for thromboprophylaxis after hip or knee replacement: pooled analysis of major venous thromboembolism and bleeding in 8464 patients from the ADVANCE-2 and ADVANCE-3 trials. J Bone Joint Surg Br. 2012 Feb. 94(2):257-64.
66. Lassen MR, Gallus A, Raskob GE, Pineo G, Chen D, Ramirez LM. Apixaban versus enoxaparin for thromboprophylaxis after hip replacement. N Engl J Med. 2010 Dec 23. 363(26):2487-98.
67. Lassen MR, Raskob GE, Gallus A, Pineo G, Chen D, Hornick P. Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): a randomised double-blind trial. Lancet. 2010 Mar 6. 375(9717):807-15.
68. Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M, et al. Oral apixaban for the treatment of acute venous thromboembolism. N Engl J Med. 2013 Aug 29. 369(9):799-808.
69. Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M, et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med. 2013 Feb 21. 368(8):699-708.
70. Schulman S, Kearon C, Kakkar AK, Mismetti P, Schellong S, Eriksson H, et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med. 2009 Dec 10. 361(24):2342-52.
71. Schulman S, Kakkar AK, Goldhaber SZ, Schellong S, Eriksson H, Mismetti P, et al. Treatment of acute venous thromboembolism with dabigatran or warfarin and pooled analysis. Circulation. 2014 Feb 18. 129(7):764-72.
72. Schulman S, Kearon C, Kakkar AK, Schellong S, Eriksson H, Baanstra D, et al. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med. 2013 Feb 21. 368(8):709-18.
73. Prandoni P, Prins MH, Lensing AW, Ghirarduzzi A, Ageno W, Imberti D, et al. Residual thrombosis on ultrasonography to guide the duration of anticoagulation in patients with deep venous thrombosis: a randomized trial. Ann Intern Med. 2009 May 5. 150(9):577-85.
74. Lee AY, Levine MN, Baker RI, Bowden C, Kakkar AK, Prins M, et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. N Engl J Med. 2003 Jul 10. 349(2):146-53.
75. Hull R, Pineo G, Mah A, et al. A randomized trial evaluating long term low molecular weight heparin therapy for three months verses intravenous heparin followed by warfarin sodium. Blood 100. 2002. 148a.
76. Pettilä V, Kaaja R, Leinonen P, Ekblad U, Kataja M, Ikkala E. Thromboprophylaxis with low molecular weight heparin (dalteparin) in pregnancy. Thromb Res. 1999 Nov 15. 96(4):275-82.
77. Zidane M, Schram MT, Planken EW, Molendijk WH, Rosendaal FR, van der Meer FJ, et al. Frequency of major hemorrhage in patients treated with unfractionated intravenous heparin for deep venous thrombosis or pulmonary embolism: a study in routine clinical practice. Arch Intern Med. 2000 Aug 14-28. 160(15):2369-73.
78. Enden T, Haig Y, Kløw NE, et al. Long-term outcome after additional catheter-directed thrombolysis versus standard treatment for acute iliofemoral deep vein thrombosis (the CaVenT study): a randomized controlled trial. Lancet. December 2011.
79. Prandoni P, Lensing AW, Prins MH, Frulla M, Marchiori A, Bernardi E, et al. Below-knee elastic compression stockings to prevent the post-thrombotic syndrome: a randomized, controlled trial. Ann Intern Med. 2004 Aug 17. 141(4):249-56.
80. Partsch H. Ambulation and compression after deep vein thrombosis: dispelling myths. Semin Vasc Surg. 2005 Sep. 18(3):148-52.
81. Kahn SR, Shrier I, Kearon C. Physical activity in patients with deep venous thrombosis: a systematic review. Thromb Res. 2008. 122(6):763-73.
82. Agnelli G, Prandoni P, Santamaria MG, Bagatella P, Iorio A, Bazzan M, et al. Three months versus one year of oral anticoagulant therapy for idiopathic deep venous thrombosis. Warfarin Optimal Duration Italian Trial Investigators. N Engl J Med. 2001 Jul 19. 345(3):165-9.
83. Bauer KA, Eriksson BI, Lassen MR, Turpie AG. Fondaparinux compared with enoxaparin for the prevention of venous thromboembolism after elective major knee surgery. N Engl J Med. 2001 Nov 1. 345(18):1305-10.
84. Berend KR, Lombardi AV Jr. Multimodal venous thromboembolic disease prevention for patients undergoing primary or revision total joint arthroplasty: the role of aspirin. Am J Orthop (Belle Mead NJ). 2006 Jan. 35(1):24-9.
85. Boudes PF. The challenges of new drugs benefits and risks analysis: lessons from the ximelagatran FDA Cardiovascular Advisory Committee. Contemp Clin Trials. 2006 Oct. 27(5):432-40.
86. Breddin HK. Low molecular weight heparins in the prevention of deep-vein thrombosis in general surgery. Semin Thromb Hemost. 1999. 25 Suppl 3:83-9.
87. Bulger CM, Jacobs C, Patel NH. Epidemiology of acute deep vein thrombosis. Tech Vasc Interv Radiol. 2004 Jun. 7(2):50-4.
88. Burke DT. Prevention of deep venous thrombosis: overview of available therapy options for rehabilitation patients. Am J Phys Med Rehabil. 2000 Sep-Oct. 79(5 Suppl):S3-8.
89. Büller HR, Agnelli G, Hull RD, Hyers TM, Prins MH, Raskob GE. Antithrombotic therapy for venous thromboembolic disease: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004 Sep. 126(3 Suppl):401S-428S.
90. Camporese G, Bernardi E, Prandoni P, Noventa F, Verlato F, Simioni P, et al. Low-molecular-weight heparin versus compression stockings for thromboprophylaxis after knee arthroscopy: a randomized trial. Ann Intern Med. 2008 Jul 15. 149(2):73-82.
91. Caprini JA, Arcelus JI, Maksimovic D, Glase CJ, Sarayba JG, Hathaway K. Thrombosis prophylaxis in orthopedic surgery: current clinical considerations. J South Orthop Assoc. 2002 Winter. 11(4):190-6.
92. Cham MD, Yankelevitz DF, Shaham D, Shah AA, Sherman L, Lewis A, et al. Deep venous thrombosis: detection by using indirect CT venography. The Pulmonary Angiography-Indirect CT Venography Cooperative Group. Radiology. 2000 Sep. 216(3):744-51.
93. Chan WS, Spencer FA, Lee AY, et al. Safety of withholding anticoagulation in pregnant women with suspected deep vein thrombosis following negative serial compression ultrasound and iliac vein imaging. CMAJ. 2013 Feb 11.
94. Cho JS, Martelli E, Mozes G, Miller VM, Gloviczki P. Effects of thrombolysis and venous thrombectomy on valvular competence, thrombogenicity, venous wall morphology, and function. J Vasc Surg. 1998 Nov. 28(5):787-99.
95. Coche EE, Hamoir XL, Hammer FD, Hainaut P, Goffette PP. Using dual-detector helical CT angiography to detect deep venous thrombosis in patients with suspicion of pulmonary embolism: diagnostic value and additional findings. AJR Am J Roentgenol. 2001 Apr. 176(4):1035-9.
96. Colwell C, Mouret P. Ximelagatran for the prevention of venous thromboembolism following elective hip or knee replacement surgery. Semin Vasc Med. 2005 Aug. 5(3):266-75.
97. Comerota AJ, Throm RC, Mathias SD, Haughton S, Mewissen M. Catheter-directed thrombolysis for iliofemoral deep venous thrombosis improves health-related quality of life. J Vasc Surg. 2000 Jul. 32(1):130-7.
98. Comp PC, Spiro TE, Friedman RJ, Whitsett TL, Johnson GJ, Gardiner GA Jr, et al. Prolonged enoxaparin therapy to prevent venous thromboembolism after primary hip or knee replacement. Enoxaparin Clinical Trial Group. J Bone Joint Surg Am. 2001 Mar. 83-A(3):336-45.
99. Deitelzweig S, Jaff MR. Medical management of venous thromboembolic disease. Tech Vasc Interv Radiol. 2004 Jun. 7(2):63-7.
100. Dranitsaris G, Stumpo C, Smith R, Bartle W. Extended dalteparin prophylaxis for venous thromboembolic events: cost-utility analysis in patients undergoing major orthopedic surgery. Am J Cardiovasc Drugs. 2009. 9(1):45-58.
101. Effectiveness of intermittent pneumatic compression in reduction of risk of deep vein thrombosis in patients who have had a stroke (CLOTS 3): a multicentre randomised controlled trial. Lancet. 2013 May 31
102. Eklof B, Arfvidsson B, Kistner RL, Masuda EM. Indications for surgical treatment of iliofemoral vein thrombosis. Hematol Oncol Clin North Am. 2000 Apr. 14(2):471-82.
103. Epstein NE. Efficacy of pneumatic compression stocking prophylaxis in the prevention of deep venous thrombosis and pulmonary embolism following 139 lumbar laminectomies with instrumented fusions. J Spinal Disord Tech. 2006 Feb. 19(1):28-31.
104. Eriksson BI, Borris LC, Friedman RJ, Haas S, Huisman MV, Kakkar AK, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med. 2008 Jun 26. 358(26):2765-75.
105. Francis CW, Berkowitz SD, Comp PC, Lieberman JR, Ginsberg JS, Paiement G, et al. Comparison of ximelagatran with warfarin for the prevention of venous thromboembolism after total knee replacement. N Engl J Med. 2003 Oct 30. 349(18):1703-12.
106. Geerts WH, Heit JA, Clagett GP, Pineo GF, Colwell CW, Anderson FA Jr, et al. Prevention of venous thromboembolism. Chest. 2001 Jan. 119(1 Suppl):132S-175S.
107. Gerotziafas GT, Samama MM. Heterogeneity of synthetic factor Xa inhibitors. Curr Pharm Des. 2005. 11(30):3855-76.
108. Gillies TE, Ruckley CV, Nixon SJ. Still missing the boat with fatal pulmonary embolism. Br J Surg. 1996 Oct. 83(10):1394-5.
109. Heit JA, Silverstein MD, Mohr DN, Petterson TM, O'Fallon WM, Melton LJ 3rd. Risk factors for deep vein thrombosis and pulmonary embolism: a population-based case-control study. Arch Intern Med. 2000 Mar 27. 160(6):809-15.
110. Henderson D. DVT in Pregnancy Ruled Out by Serial Doppler Ultrasound. Medscape Medical News. Jan 14 2013.
111. Hirsh J, Guyatt G, Albers GW, Harrington R, Schünemann HJ, American College of Chest Physician. Antithrombotic and thrombolytic therapy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008 Jun. 133(6 Suppl):110S-112S
112. Hull RD, Pineo GF, Francis C, Bergqvist D, Fellenius C, Soderberg K, et al. Low-molecular-weight heparin prophylaxis using dalteparin extended out-of-hospital vs in-hospital warfarin/out-of-hospital placebo in hip arthroplasty patients: a double-blind, randomized comparison. North American Fragmin Trial Investigators. Arch Intern Med. 2000 Jul 24. 160(14):2208-15.
113. Hull RD, Pineo GF, Stein PD, Mah AF, MacIsaac SM, Dahl OE, et al. Timing of initial administration of low-molecular-weight heparin prophylaxis against deep vein thrombosis in patients following elective hip arthroplasty: a systematic review. Arch Intern Med. 2001 Sep 10. 161(16):1952-60.
114. Iskander GA, Nelson RS, Morehouse DL, Tenquist JE, Szlabick RE. Incidence and propagation of infrageniculate deep venous thrombosis in trauma patients. J Trauma. 2006 Sep. 61(3):695-700.
115. Kakkar AK, Brenner B, Dahl OE, Eriksson BI, Mouret P, Muntz J, et al. Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double-blind, randomised controlled trial. Lancet. 2008 Jul 5. 372(9632):31-9.
116. Katz DS, Hon M. Current DVT imaging. Tech Vasc Interv Radiol. 2004 Jun. 7(2):55-62.
117. Kearon C. Epidemiology of venous thromboembolism. Semin Vasc Med. 2001. 1(1):7-26.
118. Kearon C, Ginsberg JS, Julian JA, Douketis J, Solymoss S, Ockelford P, et al. Comparison of fixed-dose weight-adjusted unfractionated heparin and low-molecular-weight heparin for acute treatment of venous thromboembolism. JAMA. 2006 Aug 23. 296(8):935-42.
119. Kearon C, Ginsberg JS, Kovacs MJ, Anderson DR, Wells P, Julian JA, et al. Comparison of low-intensity warfarin therapy with conventional-intensity warfarin therapy for long-term prevention of recurrent venous thromboembolism. N Engl J Med. 2003 Aug 14. 349(7):631-9.
120. Kearon C, Julian JA, Newman TE, Ginsberg JS. Noninvasive diagnosis of deep venous thrombosis. McMaster Diagnostic Imaging Practice Guidelines Initiative. Ann Intern Med. 1998 Apr 15. 128(8):663-77.
121. Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ. Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008 Jun. 133(6 Suppl):454S-545S.
122. Keeney JA, Clohisy JC, Curry MC, Maloney WJ. Efficacy of combined modality prophylaxis including short-duration warfarin to prevent venous thromboembolism after total hip arthroplasty. J Arthroplasty. 2006 Jun. 21(4):469-75.
123. Knight LC, Baidoo KE, Romano JE, Gabriel JL, Maurer AH. Imaging pulmonary emboli and deep venous thrombi with 99mTc-bitistatin, a platelet-binding polypeptide from viper venom. J Nucl Med. 2000 Jun. 41(6):1056-64.
124. Korelitz BI, Sommers SC. Responses to drug therapy in ulcerative colitis. Evaluation by rectal biopsy and histopathological changes. Am J Gastroenterol. 1975 Nov. 64(5):365-70.
125. Lachiewicz PF, Kelley SS, Haden LR. Two mechanical devices for prophylaxis of thromboembolism after total knee arthroplasty. A prospective, randomised study. J Bone Joint Surg Br. 2004 Nov. 86(8):1137-41.
126. Lassen MR, Ageno W, Borris LC, Lieberman JR, Rosencher N, Bandel TJ, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med. 2008 Jun 26. 358(26):2776-86.
127. Lassen MR, Bauer KA, Eriksson BI, Turpie AG. Postoperative fondaparinux versus preoperative enoxaparin for prevention of venous thromboembolism in elective hip-replacement surgery: a randomised double-blind comparison. Lancet. 2002 May 18. 359(9319):1715-20.
128. Leonardi MJ, McGory ML, Ko CY. The rate of bleeding complications after pharmacologic deep venous thrombosis prophylaxis: a systematic review of 33 randomized controlled trials. Arch Surg. 2006 Aug. 141(8):790-7; discussion 797-9.
129. Linkins LA, Choi PT, Douketis JD. Clinical impact of bleeding in patients taking oral anticoagulant therapy for venous thromboembolism: a meta-analysis. Ann Intern Med. 2003 Dec 2. 139(11):893-900.
130. Lotke PA, Lonner JH. The benefit of aspirin chemoprophylaxis for thromboembolism after total knee arthroplasty. Clin Orthop Relat Res. 2006 Nov. 452:175-80.
131. Loud PA, Katz DS, Bruce DA, Klippenstein DL, Grossman ZD. Deep venous thrombosis with suspected pulmonary embolism: detection with combined CT venography and pulmonary angiography. Radiology. 2001 May. 219(2):498-502.
132. Loud PA, Katz DS, Klippenstein DL, Shah RD, Grossman ZD. Combined CT venography and pulmonary angiography in suspected thromboembolic disease: diagnostic accuracy for deep venous evaluation. AJR Am J Roentgenol. 2000 Jan. 174(1):61-5.
133. Merli GJ. Prophylaxis for deep venous thrombosis and pulmonary embolism in the surgical patient. Clin Cornerstone. 2000. 2(4):15-28.
134. Michota F, Merli G. Anticoagulation in special patient populations: are special dosing considerations required?. Cleve Clin J Med. 2005 Apr. 72 Suppl 1:S37-42.
135. Mismetti P, Quenet S, Levine M, Merli G, Decousus H, Derobert E, et al. Enoxaparin in the treatment of deep vein thrombosis with or without pulmonary embolism: an individual patient data meta-analysis. Chest. 2005 Oct. 128(4):2203-10.
136. Muntz JE, Friedman RJ, eds. Case Vignettes: Thromboprophylaxis in Arthroscopic Surgery. Elsevier Excerpta Medica. 2006.
137. Quinlan DJ, McQuillan A, Eikelboom JW. Low-molecular-weight heparin compared with intravenous unfractionated heparin for treatment of pulmonary embolism: a meta-analysis of randomized, controlled trials. Ann Intern Med. 2004 Feb 3. 140(3):175-83.
138. Ramzi DW, Leeper KV. DVT and pulmonary embolism: Part II. Treatment and prevention. Am Fam Physician. 2004 Jun 15. 69(12):2841-8.
139. Rhodes JM, Cho JS, Gloviczki P, Mozes G, Rolle R, Miller VM. Thrombolysis for experimental deep venous thrombosis maintains valvular competence and vasoreactivity. J Vasc Surg. 2000 Jun. 31(6):1193-205.
140. Ridker PM, Goldhaber SZ, Danielson E, Rosenberg Y, Eby CS, Deitcher SR, et al. Long-term, low-intensity warfarin therapy for the prevention of recurrent venous thromboembolism. N Engl J Med. 2003 Apr 10. 348(15):1425-34.
141. Rosendaal FR. Venous thrombosis: a multicausal disease. Lancet. 1999 Apr 3. 353(9159):1167-73.
142. Snyder BK. Venous thromboembolic prophylaxis: the use of aspirin. Orthop Nurs. 2008 Jul-Aug. 27(4):225-30; quiz 231-2.
143. Sors H, Meyer G. Place of aspirin in prophylaxis of venous thromboembolism. Lancet. 2000 Apr 15. 355(9212):1288-9.
144. Taillefer R, Edell S, Innes G, Lister-James J. Acute thromboscintigraphy with (99m)Tc-apcitide: results of the phase 3 multicenter clinical trial comparing 99mTc-apcitide scintigraphy with contrast venography for imaging acute DVT. Multicenter Trial Investigators. J Nucl Med. 2000 Jul. 41(7):1214-23.
145. Turpie AG, Bauer KA, Eriksson BI, Lassen MR. Fondaparinux vs enoxaparin for the prevention of venous thromboembolism in major orthopedic surgery: a meta-analysis of 4 randomized double-blind studies. Arch Intern Med. 2002 Sep 9. 162(16):1833-40.
146. Turpie AG, Lassen MR, Davidson BL, Bauer KA, Gent M, Kwong LM, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD4): a randomised trial. Lancet. 2009 May 16. 373(9676):1673-80.
147. van Dongen CJ, MacGillavry MR, Prins MH. Once versus twice daily LMWH for the initial treatment of venous thromboembolism. Cochrane Database Syst Rev. 2005 Jul 20. CD003074.
148. Vedantham S, Millward SF, Cardella JF, Hofmann LV, Razavi MK, Grassi CJ, et al. Society of Interventional Radiology position statement: treatment of acute iliofemoral deep vein thrombosis with use of adjunctive catheter-directed intrathrombus thrombolysis. J Vasc Interv Radiol. 2006 Apr. 17(4):613-6.
149. Wells PS, Anderson DR, Rodger MA, Forgie MA, Florack P, Touchie D, et al. A randomized trial comparing 2 low-molecular-weight heparins for the outpatient treatment of deep vein thrombosis and pulmonary embolism. Arch Intern Med. 2005 Apr 11. 165(7):733-8.
150. Goodacre S. In the clinic. Deep venous thrombosis. Ann Intern Med 2008; 149:ITC3.
151. Heit JA. The epidemiology of venous thromboembolism in the community. Arterioscler Thromb Vasc Biol 2008; 28:370.
152. Pomero F, Dentali F, Borretta V, et al. Accuracy of emergency physician-performed ultrasonography in the diagnosis of deep-vein thrombosis: a systematic review and meta-analysis. Thromb Haemost 2013; 109:137.
153. Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders