Capítulo 11 - Aneurismas
11.1 Definición
Los aneurismas, que se definen como un aumento de ≥ 50% en el diámetro arterial comparado con el segmento normal, se forman como resultado de una debilidad localizada en la pared arterial.
Los aneurismas verdaderos comprometen las 3 capas de la arteria (íntima, media y adventicia).
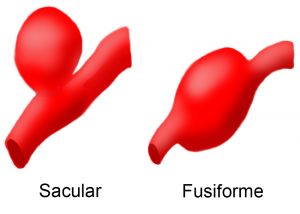
Los aneurismas se clasifican en fusiformes (ensanchamiento circunferencial de la arteria) o saculares (evaginación localizada de la pared arterial).
Fig.1 Tipos de aneurismas
Las varias capas de trombos que se forman en la luz del aneurisma (trombos laminares) pueden tapizar las paredes de ambos tipos de aneurismas y generalmente permiten que el flujo sanguíneo distal al aneurisma sea normal o casi normal.
Los aneurismas pueden aparecer en cualquier arteria. Los de la aorta abdominal y torácica son los más frecuentes y significativos, mientras que los aneurismas de las ramas principales de la aorta (arterias subclavias y esplácnicas) son mucho menos frecuentes.
11.2 Histopatología
Hasta hace poco se creía que el proceso de formación de aneurismas era parecido al de la aterogénesis, pero investigaciones recientes han demostrado que aunque ambos procesos comparten algunas características comunes, son procesos diferentes. Mientras que en la aterosclerosis se produce un proceso
proliferativo de la íntima, en los aneurismas hay un debilitamiento de la adventicia y de la media que disminuyen la capacidad de resistencia de la pared a la presión arterial y que favorece su adelgazamiento , dilatación y finalmente la formación de un aneurisma. La presencia de lesiones ateroscleróticas no son la causa del aneurisma sino una consecuencia de las turbulencias sanguíneas en la luz del mismo. Además no existe una correlación entre la presencia de aneurisma y el grado de aterosclerosis sistémica. Los aneurismas son consecuencia de procesos que degradan o alteran los componentes estructurales de la pared, especialmente colágeno y elástica.
Estas alteraciones están muy influenciadas por procesos inflamatorios, proteolíticos y de estrés mecánico sobre la pared arterial que contribuyen a los procesos degenerativos que caracterizan a muchos de los aneurismas, especialmente de la aorta abdominal y de la aorta torácica descendente. Son mediados por linfocitos B y T, macrófagos, citocinas inflamatorias y metaloproteinasas que degradan la elastina y el colágeno alterando la potencia tensil y la capacidad de la aorta para "soportar" la distensión pulsátil.
La mayor presencia de aneurismas en aorta abdominal también podría relacionarse con diferencias biomecánicas. La menor cantidad de capas de elastina y de vasa vasorum en la aorta distal hace que esta sea mas rígida y tenga menor distensibilidad y resistencia ante la presión sanguínea. Igualmente, en esta región, la pared de la aorta está sometida a mayores oscilaciones de flujo y turbulencias que aumentan la presión tangencial localmente. Este efecto se ve potenciado por la propia turbulencia generada por la forma del aneurisma que aumenta aún mas las turbulencias locales.
Estas mismas alteraciones en el flujo van a favorecer la aparición de un trombo que tiene dos efectos contrapuestos, por un lado actúa amortiguando la tensión parietal un 38% y, por tanto, disminuyendo la transmisión de la presión a la pared del aneurisma y previniendo el riesgo de ruptura; por otro lado el trombo contiene una alta concentración de enzimas proteolíticas y activadores enzimáticos que pueden actuar destruyendo los elementos estructurales de la pared del aneurisma y facilitar la dilatación del mismo.
El cuadro histopatológico que surge denota la destrucción de la elastina y del colágeno, disminución del músculo de fibra lisa en la aorta, "penetración" de vasos neoformados de
la vasa vasorum e inflamación.
11.3 Etiología
Las causas de la aparición de aneurismas se pueden dividir en 5 grupos:
1.-Degenerativas o inespecíficas (antes ateroscleróticos).
2.-Secundarias a trastornos hereditarios o del desarrollo
3.-Infecciones
4.-Vasculitis
5.-Traumatismos
1.- Los aneurismas degenerativos son los mas frecuentes. Entre los factores asociados o predisponentes están: envejecimiento, tabaquismo, hipercolesterolemia, ser varón y antecedente familiar de aneurismas de aorta.
2.- El término necrosis quística de la media se emplea para describir la degeneración del colágeno y las fibras elásticas de la túnica media de la aorta, así como la pérdida de células de la media, que son reemplazadas por múltiples grietas de material mucoide. Es característico que la necrosis quística de la media afecte a la aorta proximal, provocando debilidad y dilatación circunferencial, e induzca el desarrollo de aneurismas fusiformes que afectan a la aorta ascendente y a los senos de Valsalva. El trastorno prevalece especialmente en sujetos con síndrome de Marfan, o Ehlers-Danlos de tipo IV, hipertensión, válvula aórtica bicúspide congénita y síndromes familiares de aneurisma de aorta torácica. En ocasiones se manifiesta por un cuadro aislado en individuos sin otro trastorno manifiesto.
En el 20% de los pacientes hay "agrupamiento" familiar de aneurismas aórticos, lo cual sugiere que la enfermedad tiene un origen hereditario. Se ha dicho que en algunos casos de los síndromes de Marfan y de Ehlers-Danlos tipo IV intervienen mutaciones de genes que codifican la fibrilina 1 y el pro colágeno de tipo III, respectivamente. El análisis de ligamiento ha identificado loci en los cromosomas 5ql3-14, 1 Iq23.3-q24 y 3p24-25 en algunas familias, aunque no se han descrito los alelos específicos.
3.- Entre las causas infecciosas de los aneurismas aórticos están la sífilis, la tuberculosis y otras infecciones bacterianas. La sífilis es ahora una causa relativamente infrecuente de aneurisma aórtico. La periaortitis y la mesoaortitis sifilíticas dañan las fibras elásticas, con lo que la pared aórtica aumenta de espesor y se debilita. Aproximadamente 90% de los aneurismas sifilíticos están localizados en la aorta ascendente y en el cayado. Los aneurismas tuberculosos suelen afectar a la aorta torácica y son consecuencia de la extensión directa de la infección a partir de los ganglios linfáticos hiliares o los abscesos vecinos, o bien por siembra bacteriana. La destrucción granulomatosa de la capa media provoca que la pared aórtica pierda elasticidad.
Un aneurisma micótico es una lesión poco frecuente que se produce a consecuencia de infecciones por estafilococos, estreptococos o salmonelas de la aorta, habitualmente sobre una placa aterosclerótica. Estos aneurismas suelen ser sacciformes. Los hemocultivos suelen ser positivos y revelan el agente causal.
4.- Las vasculitis que se relacionan con aneurismas aórticos son la arteritis de Takayasu y la arteritis de células gigantes, que pueden provocar aneurismas del cayado aórtico y de la aorta torácica descendente. Las espondiloartropatías, como la espondilitis anquilosante, artritis reumatoide, artritis psoriásica, policondritis recidivante y síndrome de Reiter, se asocian a dilatación de la aorta
ascendente. El síndrome de Behçet causa aneurismas torácicos y abdominales.
5.- Los aneurismas traumáticos pueden desarrollarse como consecuencia de traumatismo torácico penetrante o no penetrante, y a menudo afectan a la aorta descendente, por debajo de la inserción del ligamento arterioso. La disección crónica de la aorta se acompaña de debilitamiento de la pared de dicho vaso, que culmina a veces en la aparición de la dilatación aneurismática.
Para su estudio dividiremos los aneurismas en tres grupos topográficos: aorta y sus ramas viscerales, miembro superior y miembro inferior.
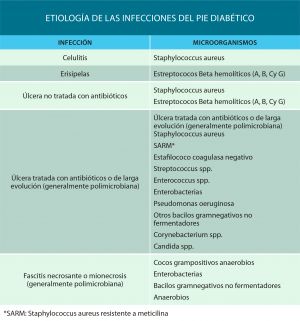
Tabla1. Etiología Aneurismas
11.4 Aneurismas de Aorta
Dependiendo de la localización del aneurisma aórtico vamos a dividirlos en cuatro grupos para un estudio más pormenorizado: aneurismas torácicos, aneurismas de aorta infrarrenal, aneurismas toracoabdominales y aneurismas de las ramas de la aorta abdominal.
11.4.1 Aorta Torácica
11.4.1.1 Etiología
La causa más frecuente de los aneurismas de la aorta ascendente es la degeneración quística de la media. Mientras que los aneurismas del cayado y de la aorta torácica descendente suelen ser degenerativos, pero en esta región es importante tener en cuenta el grupo de enfermedades hereditarias del colágeno.
11.4.1.2 pidemiología
Los aneurismas de la aorta torácica (AAT) se clasifican según la región que afectan: ascendente (60%), descendente (39%) o cayado aórtico (10%), por orden de frecuencia. Aparece de forma particularmente frecuente en el tramo que va del arco aórtico a la aorta ascendente. La prevalencia no es muy precisa pero parece afectar a 6 personas/100.000 habitantes/año. La relación hombre/mujer es 2:1. La edad de presentación es entre los 64 y 69 años.
11.4.1.3 Evolución natural
El 31% de los pacientes diagnosticados de aneurisma de aorta torácica que no son tratados mueren en los 2 años siguientes, la mitad por rotura del aneurisma. Los factores de riesgo asociados a la rotura son tabaquismo, EPOC e insuficiencia renal.
La velocidad media de crecimiento de los AAT es 1 mm/año.La presencia de una disección crónica aumenta la velocidad de crecimiento hasta 3,7 mm/año. Los AAT descendente crecen mas rápido que los de aorta ascendente y los fumadores multiplican por 2 la velocidad de crecimiento. La tasa de supervivencia oscila, según los diferentes estudios, entre el 39% y 87% en el primer año, y entre el 13% y 46% a los 5 años.
11.4.1.4 Clínica
Las manifestaciones clínicas de los aneurismas de la aorta torácica dependen de su localización y tamaño. Habitualmente son asintomáticos. Los síntomas aparecen cuando comprime otros órganos, se diseca o se rompe. La clínica depende de la compresión o erosión de los tejidos adyacentes: dolor torácico-dorsal, disnea, tos, sibilancias o hemoptisis (por compresión o erosión traqueal o bronquial), disfonía (por compresión del nervio laríngeo recurrente izquierdo) o disfagia (por compresión esofágica), insuficiencia cardíaca congestiva (por insuficiencia aórtica), infarto de miocardio (por compresión de las arterias coronarias), congestión de la cabeza, cuello y brazos (síndrome de la vena cava superior, por compresión de la misma) o embolismos distales (por formación de trombos murales).
La complicación más grave suele ser la rotura del aneurisma, que puede provocar dolor intenso, hemoptisis o hematemesis (por rotura hacia bronquios o esófago), inestabilidad hemodinámica o muerte súbita.
El riesgo de rotura está relacionado con su diámetro y aumenta de forma importante en los aneurismas de aorta ascendente >5,5 cm y en los de la aorta torácica descendente de más de 6 cm.
Ante un cuadro clínico de dolor torácico, la presencia de asimetría en el pulso o de déficit neurológico focal en un paciente con un aneurisma torácico debe hacernos sospechar una disección torácica.
A la inversa, una radiografía de tórax normal o la ausencia de dolor de inicio brusco hacen que la probabilidad de que se trate de una disección aórtica sea menor, aunque no debe ser la única prueba de imagen ante una sospecha de disección.
11.4.1.5 Métodos diagnósticos
Los objetivos de las pruebas diagnósticas son identificar la aorta y sus ramas, diagnosticar y definir el tipo de aneurisma (fusiforme o sacular), determinar las dimensiones transversales y longitudinales del aneurisma, detectar patologías asociadas que puedan influir en el tratamiento, seguimiento evolutivo y definición anatómica antes de proceder a un tratamiento quirúrgico o endovascular.
Los aneurismas de la aorta torácica constituyen un hallazgo radiológico casual frecuente (ensanchamiento mediastínico y desplazamiento o compresión de la tráquea o bronquio principal izquierdo en RX simple de tórax). Ante la sospecha clínica, incluso si la radiografía de tórax es normal, no debe descartarse su existencia y debemos recurrir a otras pruebas diagnósticas.
La aortografía ha sido sustituida por técnicas diagnósticas de imagen menos invasivas, como la ecografía transesofágica, la tomografía computarizada (TC) y la resonancia magnética nuclear (RMN).
El TC y la resonancia magnética son pruebas sensibles para valorar los aneurismas de la aorta, muy útiles para determinar su localización y tamaño, así como para el seguimiento post-quirúrgico o endovascular.
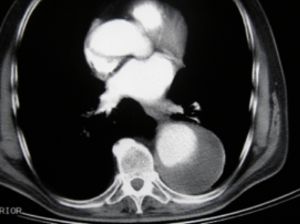
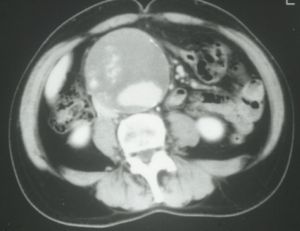
Fig. 2 AngioTAC: Aneurisma aorta descendente
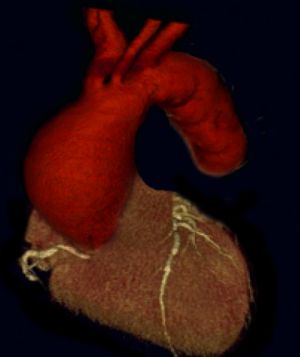
Fig. 3 AngioTAC 3D de aneurisma aorta ascendente
La ecografía transesofágica permite revisar la aorta ascendente proximal y la aorta descendente.
La ecografía transtorácica únicamente evalúa la aorta ascendente.
La aortografía se reserva para el estudio preoperatorio, ya que proporciona información sobre la longitud del aneurisma y la afección de las ramas.
En los casos en los que no está indicada la intervención quirúrgica se debe realizar seguimiento mediante TC con contraste o resonancia magnética cada seis a doce meses para vigilar la expansión.
11.4.1.6 Tratamiento
Tratamiento farmacológico:En los pacientes con aneurisma de la aorta torácica, en especial aquellos pacientes con síndrome de Marfan, se recomienda el tratamiento con Losartán (un antagonista del receptor de la angiotensina) y el control estricto farmacológico de la tensión arterial.
Tratamiento quirúrgico : De forma general, en aneurismas de aorta torácica ascendente y cayado está indicada cirugía en:
Aneurisma sintomático.
Aneurismas de más de 6 cm, cirugía preferente.
Aneurismas de más de 5,5 cm, cirugía programada.
Aneurismas de diámetro entre 4 y 5 cm se realiza seguimiento cada seis meses y cirugía en el caso de que aumenten más de 0,5 cm por año.
En caso de aneurismas de aorta ascendente >4,5 cm que vayan a precisar intervención valvular aórtica.
En los casos con síndrome de Marfan se debe considerar la intervención quirúrgica en los aneurismas de aorta torácica entre 4 y 5 cm dependiendo de la situación clínica.
Además del diámetro, en los aneurismas de aorta torácica descendente, si existe riesgo de rotura, la indicación de cirugía se establece en el momento del diagnóstico.
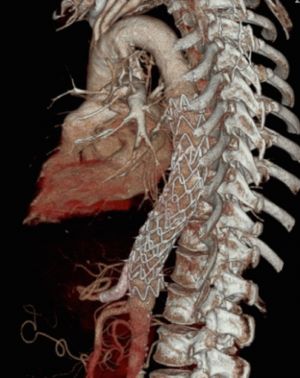
Fig. 4 Endoprótesis en AAT
Fig. 5 Prótesis de Dacron en AAT
11.4.2 Aorta Abdominal Infrarrenal
11.4.2.1 Definición
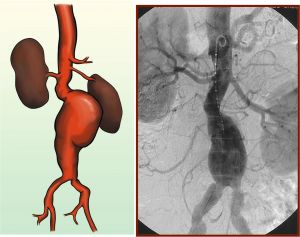
Un aneurisma de aorta infrarrenal es una dilatación (>50% del diámetro proximal normal), generalmente fusiforme, que se origina por debajo de las arterias renales y llega hasta la bifurcación aórtica e incluso puede afectar a las arterias iliacas. Microscópicamente se corresponden en la mayoría de los casos a cambios degenerativos con un marcado adelgazamiento de la capa media muscular.
Fig. 6 Aneurisma infrarrenal. Esquema y arteriografía
11.4.2.2 Epidemiología
Normalmente antes se solían diagnosticar en la séptima década de la vida pero los avances en las técnicas radiológicas, el amplio uso de estas pruebas para otras enfermedades y el mayor interés de la población por su salud ha permitido adelantar la edad media de detección en una o dos décadas. La proporción es de 1:4/6 mujer/hombre y la prevalencia estimada es del 2%-5% de los varones mayores de 60 años. Trasladadas estas cifras a la población española estaríamos hablando de aproximadamente 150.000 personas portadoras de una aneurisma de aorta y con alto riesgo de morbimortalidad. Recordemos que la rotura de un aneurisma se presenta en 7 de cada 100.000 habitantes y es la décima causa de mortalidad en hombres mayores de 55 años.
Nos enfrentamos por tanto a una patología frecuente, especialmente en varones, asociada al envejecimiento de la población y a
hábitos higiénico-dietéticos inadecuados, potencialmente devastadora y con alto coste
económico y social.
11.4.2.3 Factores asociados
Múltiples factores influyen en su aparición y desarrollo.
La aorta tiene un calibre decreciente desde su nacimiento hasta su bifurcación en las arterias ilíacas. Este cambio se traduce en una mayor presión tangencial a nivel de la aorta infrarrenal (es decir, la aorta en su parte más distal, a nivel del abdomen y por debajo de las arterias renales soporta peor la fuerza que la presión sanguínea ejerce sobre su pared y tiene mayor predisposición a dilatarse con el tiempo ). Por otra parte, a este nivel existen menos capas de fibras elásticas en su pared y menor elasticidad de la misma. Por último, los vasa vasorum (los microvasos responsables de llevar sangre a las células musculares de la propia aorta ) están casi ausentes a nivel infrarrenal. Estos tres factores asociados a otro tipo de alteraciones acaba favoreciendo la aparición de aneurismas.
La asociación de aneurisma con hipertensión y tabaquismo, además de los cambios degenerativos ateromatosos locales, coronarios y cerebrales que estos enfermos padecen simultáneamente apoyaban la etiología aterosclerótica, sin embargo la polémica está servida tras la publicación de varios estudios epidemiológicos que parecen indicar que aterosclerosis y aneurismas son procesos coincidentes pero no similares. Otros mecanismos que se asocian a los aneurismas son las alteraciones genéticas, que se manifestarían a través de la degeneración de la matriz estructural, de la elástica y del colágeno de la pared aórtica (componentes no musculares de la pared de la aorta).
Existe acuerdo generalizado en señalar siete (7) factores de riesgo que influyen en el desarrollo de los aneurismas:
1.- Edad avanzada.
2.- Obesidad.
3.- Enfermedad coronaria.
4.- Padecer arteriosclerosis en algún otro territorio vascular.
5.- Hipercolesterolemia.
6.- Hipertensión arterial.
7.- Fumador.
Algunos datos adicionales a tener en cuenta son:
a.- Existe un riesgo familiar entre el 12 y el 19%.
b.- Los fumadores tienen siete veces mas posibilidad de desarrollar aneurismas de aorta.
c.- Tienen menos riesgo de desarrollar aneurismas las mujeres, los negros y los diabéticos.
d.- El riesgo de sufrir una ruptura es de un 2’2% / año, pero si es una mujer la que lo padece la posibilidad de romperse es de 2 a 4 veces la de un varón. También tienen mayores posibilidades de rotura los aneurismas de mayor diámetro, los pacientes con problemas respiratorios, los fumadores, los hipertensos y los que han sufrido transplantes de órganos.
11.4.2.4 Etiología
En un 90% se tratarán de aneurismas “degenerativos”, sea o no la aterosclerosis la causa previa. Otras causas menos frecuentes son: la necrosis quística de la media, las arteritis, las conectivopatías, los traumatismos, las infecciones y las disecciones.
11.4.2.5 Clínica
En un 75% de los casos son asintomáticos cuando se diagnostican. Se suelen descubrir en exámenes físicos rutinarios al palpar una masa pulsátil en el abdomen. Los estudios radiológicos son la otra gran fuente de diagnóstico de aneurismas asintomáticos de aorta, especialmente debido al incremento de exploraciones con ultrasonidos y scanner.
Los casos sintomáticos suelen presentar dolor abdominal o lumbar difuso y vago, que en caso de aumentos rápidos del diámetro del aneurisma pueden ser más intensos y localizado en epigastrio con irradiación a la espalda. El dolor puede estar relacionado con compresión de estructuras vecinas, especialmente con la erosión de la cara anterior de los cuerpos vertebrales lumbares. Síntomas gastrointestinales como sensación de plenitud, náusea y pérdida de peso corresponden a compresiones intestinales, comúnmente a nivel del duodeno. La hidronefrosis (cuando existe un obstáculo en las vías excretoras del riñón se produce una retención y acúmulo de orina) es más frecuente en los aneurisma inflamatorios y los ilíacos. La obstrucción ureteral completa es rara. También pueden producirse embolizaciones desde el trombo mural a las extremidades inferiores y debutar el aneurisma como una isquemia aguda de extremidades inferiores (la interrupción brusca de la llegada de sangre a una extremidad). La trombosis aguda de un aneurisma (formación brusca de un coágulo en el interior del aneurisma que interrumpe el paso de sangre) también puede ocurrir , especialmente si se asocia a enfermedad obstructiva de las arterias ilíacas.
La forma más común de diagnosticar un aneurisma sintomático es cuando se produce la ruptura. Frecuentemente ocurre en el retroperitoneo y se presenta la triada de shock, dolor abdominal o de espalda y masa pulsátil epigástrica ( por encima del ombligo ). El shock puede ser mínimo o estar ausente, dependiendo del grado de hemorragia inicial. El dolor es intenso, constante y no varía con la posición. Es frecuente la irradiación hacia genitales. Menos frecuente es la ruptura hacia duodeno (fístula aorto-entérica) o a vena cava inferior (fístula aorto-cava). El primer caso se presenta con abundantes hematemesis y melenas (sangrado por boca y ano respectivamente), en el segundo como una insuficiencia cardiaca brusca y masiva (incapacidad del corazón para bombear la sangre que llega a sus cavidades y produce sensación de ahogo –disnea– a pequeños esfuerzos o incluso en reposo y finalmente edema –acúmulos de líquidos- en piernas y pulmones).
11.4.2.6 Métodos diagnósticos
La simple palpación de una masa pulsátil epigástrica puede hacernos sospechar un aneurisma.
Cuando la masa pulsátil (el aneurisma) es mayor de 5 cm de diámetro se suele palpar en
el 76% de los casos. Si el aneurisma es de 4 cm o menor solo se palpa en el 29% de los casos.
Es importante saber que aquellas personas diagnosticadas de un aneurisma de aorta, en un 14% tienen otro aneurisma en arterias femorales o poplíteas. Sin embargo cuando lo primero que se detecta es el aneurisma femoral habrá otro en aorta en el 85% de los pacientes y cuando el primer diagnóstico es de aneurisma poplíteo en un 62% de los casos habrá otro aórtico.
Esto significada que es muy importante no limitarse solo a la palpación del abdomen sino que se debe realizar una exploración vascular completa.
En la Rx simple de abdomen se puede descubrir un aneurisma por el borde curvo calcificado de la pared del aneurisma.
Fig. 7 Rx simple abdomen. Borde calcificado
Sin embargo solo la palpación puede presentar numerosos falsos positivos y negativos y, cuando existe sospechaclínica, es imprescindible confirmarla con otros métodos diagnósticos : la ultrasonografía ( eco-doppler ) se ha convertido en el método de elección para el despistaje de los aneurismas abdominales. Tiene una sensibilidad prácticamente del 100% en aneurismas > 3 cm, aunque puede infravalorar el diámetro real del aneurisma ( media de 2,7 mm). Posteriormente puede completarse el estudio con un TAC o un ANGIOTAC o ANGIORESONANCIA de toda la aorta toracoabdominal para valorar con mayor exactitud donde comienza y donde acaba el aneurisma, su relación con las estructuras vecinas (vena cava inferior, vena renal izquierda, duodeno, uréteres ) y con las arterias viscerales. La RNM es otra técnica que aporta información similar a la anterior. La arteriografía es usada rutinariamente por algunos equipos aunque solo estaría indicada cuando existe clínica de enfermedad arterial obstructiva asociada en MM.II., sospecha de isquemia mesentérica, hipertensión vásculo-renal, deterioro de la función renal, soplos abdominales inexplicables, sospecha de extensión suprarrenal del aneurisma, evidencia de riñón en herradura o en algunos casos en que se piense realizar tratamiento endovascular.
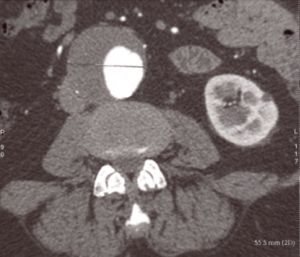
Fig. 8 AngioTAC. Aneurisma aorta abdominal
corte transversal
11.4.2.7 Evolución natural
El 13’8% de las aortas que tienen un diámetro entre 26 y 29 mm alcanzan los 55 mm en una media de 10 años.
El 2’1% de las aortas que tienen un diámetro entre 30 y 34 mm alcanzan los 55 mm en una media de 3 años.
El 10’5% de las aortas que tienen un diámetro entre 35 y 39 mm alcanzan los 55 mm en una media de 2 años.
EL 1,4% de las aortas entre 35 y 39 mm de diámetro se rompen.
Los aneurismas de aorta abdominal entre 4 y 5,5 cm tiene una mortalidad del 20% a los 3 años pero solo la cuarta parte era debida a la rotura de la aneurisma, el 40% fallecieron por otras causas cardiovasculares y el cáncer fue responsable de otro 20%.
El riesgo de rotura del aneurisma se correlaciona directamente con el diámetro del mismo, así los aneurisma entre 30 y 39 mm tuvieron un 0,9% de ruptura, de 40 a 55 mm del 2,7%, de 55 a 59 mm el 9,4% y los >70 mm el 32,5%. La media de rotura de los >55 mm es del 27,8%.
11.4.2.8 Tratamiento
En todos los casos se debe suprimir el tabaquismo y tratar los factores de riesgo cardiovascular asociados.
En los aneurismas asintomáticos se recomienda:
- Vigilancia cada 12 meses en los aneurismas con diámetro entre 35 y 44 mm.
- Vigilancia cada 6 meses en aneurismas con diámetros entre 45 y 54 mm.
- Vigilancia cada 3 años en aneurismas con diámetros entre 30 y 34 mm.
C. Vigilancia cada 5 años en aneurismas con diámetros entre 26 y 29 mm.
Si el aneurisma tiene un diámetro igual o superior a 50-55 mm o crece más de 5 mm en 6 meses o se vuelve sintomático el tratamiento debe ser quirúrgico, ya sea mediante cirugía abierta o endovascular, pero solo si el riesgo de muerte por rotura es superior a la morbimortalidad asociada a la propia cirugía.
El riesgo de muerte por rotura de un aneurisma está directamente asociado a su diámetro; así la supervivencia a 5 años de aneurismas menores de 6 cm es del 48% frente a solo un 6% de los iguales o mayores a 6 cm.
En aquellos pacientes diagnosticados de un aneurisma de aorta y no tratados el 35% de las muertes se debió a rotura del mismo ( 16%
en menores de 6 cm y 51% en mayores de 6 cm ) seguido de un 17% de muertes por enfermedad coronaria. El crecimiento medio de un aneurisma de aorta es de 0’4 cm por año.
Teniendo en cuenta los altos porcentajes de rotura , y subsecuente muerte, de los aneurismas de aorta infrarrenal > 55 mm de diámetro el tratamiento de elección debe ser quirúrgico. El riesgo de muerte perioperatoria oscila entre el 1% y el 10%, dependiendo de la edad del paciente, de las enfermedades concomitantes y de la técnica quirúrgica usada, pero si el aneurisma es sintomático el porcentaje asciende al 18% y si está roto a más del 40% de los que llegan a quirófano. La enfermedad coronaria es la principal causa de muerte en estos pacientes ya es responsable de más de la mitad de los éxitus.
En general se consideran factores pronósticos negativos para los resultados quirúrgicos la presencia de enfermedad cardiaca , evidencia de aterosclerosis en otras zonas del cuerpo, hipertensión mal controlada, insuficiencia renal con creatinina superior a 3’5, enfisema o EPOC y obesidad mórbida.
11.4.2.9 Cirugía abierta
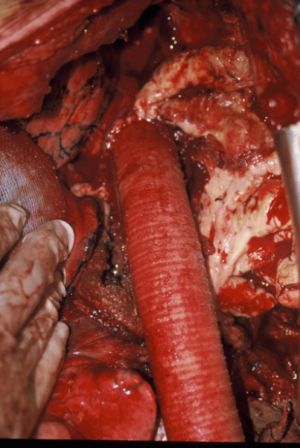
Consiste en el abordaje del aneurisma a través de una incisión abdominal, ya sea atravesando el peritoneo (laparotomía) o rodeándolo ( retroperitoneal), disección del cuello del aneurisma y de las arterias iliacas , clampaje ( cortar la circulación con un clamp o instrumento quirúrgico ) de la aorta e ilíacas, apertura del aneurisma y sustitución del mismo por una prótesis sintética recta o bifurcada que se cose a los segmentos sanos arteriales por encima y por debajo del aneurisma. Tras la cirugía, que se realiza bajo anestesia general, se precisa control post-operatorio en una unidad de vigilancia intensiva al menos las primeras 24 horas.
En los últimos años se han introducido diversas mejoras en casi todos los aspectos relacionados con el tratamiento de los aneurismas aórticos:
- por un lado el diagnóstico precoz permite adelantar en casi una década su descubrimiento y se evita que su primera manifestación es la rotura.
- por otro lado las técnicas ecográficas o isotópicas de stress (talio/dipiridamol o ecocardio/dobutamina) tienen una sensibilidad y especificidad lo suficientemente altas como para permitir detectar una enfermedad coronaria severa y tomar las medidas terapéuticas pre y peri operatorias necesarias para evitar que siga siendo la primera causa de muerte en el perioperatorio de cirugía aórtica.
- En el terreno anestésico se han producido dos grandes cambios de tendencia: cada vez se utiliza más anestesia general combinada con un catéter epidural con lo que mejora el manejo tanto quirúrgico como post-operatorio; por otro lado se enfoca el procedimiento anestésico como si todos los enfermos fueran cardiópatas y se les administran betabloqueantes perioperatoriamente ajustando la dosis a la frecuencia cardiaca. Su uso disminuye el riesgo de mortalidad cardiovascular y de infarto de miocardio o parada cardiaca no mortales. Está contraindicado su utilización solo si la frecuencia cardiaca es <55 lpm, la TAS <100 mm Hg, hay evidencia de broncoespasmo agudo, insuficiencia cardiaca congestiva y bloqueo AV de tercer grado.
- Entre las técnicas quirúrgicas, en cirugía abierta, se ha ido popularizando el abordaje retroperitoneal del aneurisma ya que se le atribuyen una serie de ventajas peri y post operatorias como son las de evitar la manipulación intestinal, mantener la integridad del peritoneo posterior evitando posibles fístulas aortoduodenales, mejor control del cuello del aneurisma, menor dolor abdominal e íleos paralíticos post operatorios y menor repercusión respiratoria que la laparotomía media. Sin embargo, la evidencia científica no ha encontrado diferencias significativas entre los distintos abordajes.
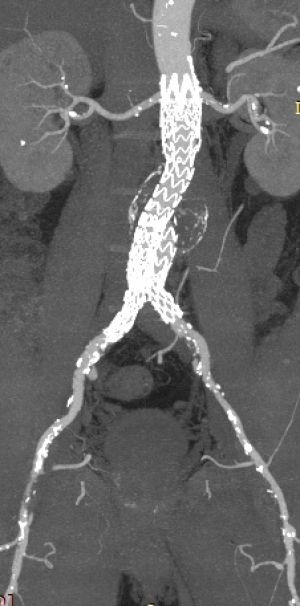
- Por último, el gran avance de las últimas dos décadas es el tratamiento endovascular de los aneurismas. La técnica consiste en la introducción a través de una arteria femoral de un introductor que permite desplegar un stent recubierto que sella el aneurisma y se ancla en una de las arterias iliacas, posteriormente, a través de la femoral contralateral se introduce una segunda endoprótesis que se encaja con la anterior.
Las complicaciones post-operatorias mas frecuentes son: Infarto de miocardio (con una relación estadísticamente significativa con Hto <28% en el post operatorio), hemorragias (relacionadas generalmente con problemas técnicos en las anastomosis o yatrogenia venosa), insuficiencia renal (sobre todo si antes de la intervención se parten de valores elevados de creatinina), colitis isquémica (1%) que se asocia a diarrea con sangre precoz, dolor en fosa ilíaca izquierda, leucocitosis e inestabilidad hemodinámica, embolismos distales a partir del trombo durante la disección quirúrgica aunque la mayoría suelen ser microembolias, la paraplejia es rara en la reparación infrarrenal y mas común en la cirugía toracoabdominal, disfunción eréctil tanto por impotencia funcional como por eyaculación retrógrada y, finalmente, TVP o TEP.
La mortalidad perioperatoria (30 días) en la cirugía abierta de aorta programada es igual o <5%, la supervivencia a 5 años es del 70% (frente a un 80% de la población general) y a los 10 años de un 40%. Las causas de muerte tardía entre los enfermos operados exitosamente de un AAA son cardiopatía (44%), cáncer (15%), rotura de otro aneurisma (11%), ACVA ((9%) y neumopatía (6%).
Fig. 9 TAC de aneurisma aorta infrarrenal previo a la cirugía
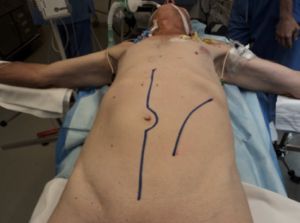
Fig. 10 Colocación del paciente en la mesa de quirófano
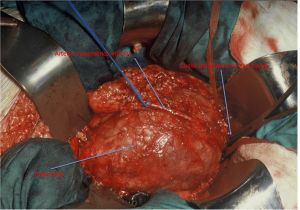
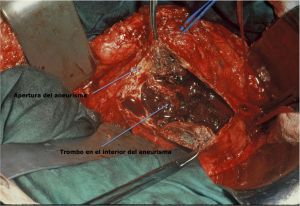
Fig. 11. Exposición del aneurisma
Fig. 12 Apertura del saco con trombo en su interior
Fig. 13 Extracción del trombo del interior del aneurisma
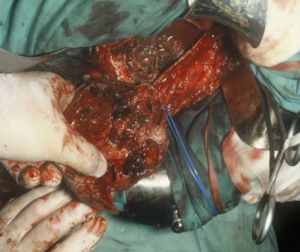
Fig. 14 Aspecto una vez extraído el trombo
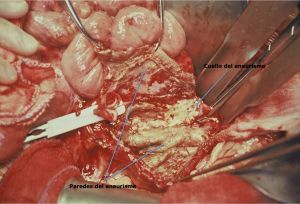
Fig. 15 Detalle del cuello de la aorta donde se suturará el injerto
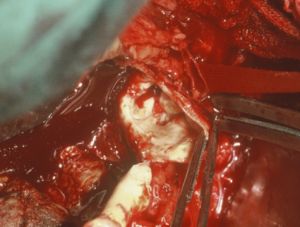
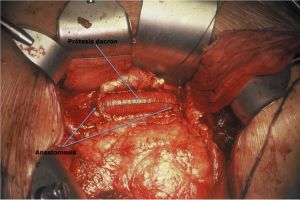
Fig. 16 Prótesis recta aorto-aórtica de Dacron
Fig. 17 Cierre de la pared del aneurisma sobre el injerto para protegerlo
11.4.2.10 Tratamiento endovascular
Parodi publicó la primera reparación endovascular de un aneurisma de aorta (REVA) en 1990. Su técnica rápidamente se popularizó y, tras los primeros años de experiencia, y con dispositivos cada vez más fáciles de manejar y más seguros, se ha revolucionado el tratamiento clásico de los aneurismas de aorta.
Las indicaciones del REVA son las mismas en cuanto a diámetro y crecimiento del aneurisma que para la cirugía abierta.
La realización de un REVA depende de una precisa planificación preparatoria que supone una dependencia completa de técnicas de imagen para decidir si un paciente puede o no ser candidato a una endoprótesis o la estrategia y el dispositivo adecuado en caso de ser candidato. Para ello el angioTAC con reconstrucción 3D es la prueba de elección hoy día.
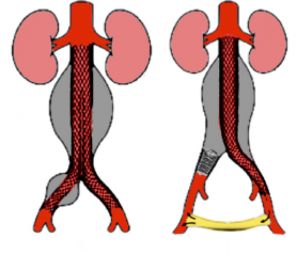
La técnica consiste en un abordaje de las arterias femorales a través de pequeñas incisiones inguinales (en algunos dispositivos actuales incluso a través de punción femoral), desde allí mediante largos dispositivos que navegan por ilíaca externa y común hasta la aorta suprarrenal, se implanta entonces la endoprótesis en la aorta infrarrenal e ilíacas de forma que el aneurisma queda excluido sin necesidad de una laparotomía, clampaje aórtico prolongado o riesgo de pérdida de sangre importante. Las dos formas habituales de implante son la endoprótesis aorta biilíaca (fig. A) y la uniilíaca con bypass fémoro-femoral y oclusión de la ilíaca contralateral (fig. B).
Fig. 18 Esquema representando diferentes formas de implantar una endoprótesis de aorta
Para realizar este procedimiento se precisan ciertos requisitos anatómicos: el cuello aórtico, definido como la zona de aorta sana proximal al aneurisma, es la zona de fijación proximal del endoinjerto y requiere una longitud libre de enfermedad de entre 10 y 15 mm por debajo de la salida de las arterias renales, la angulación del cuello, definida como la dirección del cuello en relación con el eje vertical teórico de la aorta, no debe ser >60º para un adecuado implante del injerto, igualmente la existencia de calcio o de trombo mural en el cuello del aneurisma se consideran signos desfavorables para implantar una endoprótesis. A nivel de arterias ilíacas es importante que no existan lesiones ateroscleróticas extensas o muy estenosantes que impidan la navegación del dispositivo de la endoprótesis desde la femoral hasta el cuello del aneurisma y, al igual que en el cuello, es muy importante que las arterias ilíacas no presentenangulaciones, calcificaciones o trombos murales que impidan la adecuada fijación de la endoprótesis a este nivel y fracase la exclusión del aneurisma.
La endoprótesis implantada suele consistir en una prótesis de PTFE o poliéster sustentado sobre una malla metálica que puede ser de acero, aleación de cromo-cobalto-níquel o de nitinol.
Fig. 19 Módulos de una endoprótesis
La recuperación suele ser rápida, con escasas complicaciones inmediatas y con altas en las primeras 24-48 horas. Entre las complicaciones inmediatas hay que destacar la rotura de arteria iliaca (1-2%), claudicación glútea (12-50% de los pacientes en los que hay que ocluir alguna de las hipogástricas) y disfunción eréctil de nueva aparición.
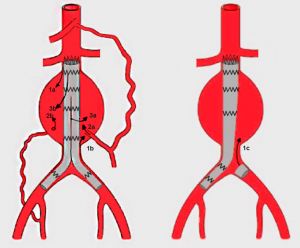
Las complicaciones tardías suelen asociarse a la presencia de endofugas (relleno de sangre del saco aneurismático excluido desde diversas posibles fuentes) y que obligan a reintervenciones entre 1,4% y 9% de los casos. Se han descrito 5 tipos de endofugas: la tipo 1 está ocasionada por un sellado inadecuado en las zonas de anclaje (cuello aórtico e ilíacas, la tipo2 están ocasionadas por flujo retrógrado en las ramas arteriales que
surgen del saco aneurismático (lumbares y arteria mesentérica inferior), las tipo 3 se producen por defectos del tejido de la prótesis o por inadecuado encaje entre los segmentos modulares la misma, la tipo 4 por exceso de porosidad de la tela del injerto o en las suturas que los anclan a la armazón metálica y las tipo 5 se caracterizan porque, aunque no se ve fuga de contraste en las pruebas de imagen, el saco del aneurisma sigue creciendo y se conoce como endotensión. Las fugas 1 y 3 tienen alto riesgo de expansión del aneurisma y rotura. En las tipo 2 la actitud suele ser expectante y si el aneurisma crece pueden ser embolizadas.
Fig. 20 Tipos de endofuga
Otras complicaciones tardía detectadas son el fallo estructural de la endoprótesis, generalmente por rotura de la estructura metálica, especialmente en las de nitinol. Las trombosis de rama de las endoprótesis pueden afectar al 11% de los pacientes y aparecen habitualmente en los 6 primeros meses tras el implante. se asocian a inadecuada elección del diámetro de la rama iliaca de la endoprótesis, tortuosidad del eje ilíaco o disecciones iatrogénicas de la ilíaca externa. El desplazamiento distal de la endoprótesis se relaciona con la angulación del cuello, la dilatación del cuello aneurismático o la contracción del saco en los años siguientes al implante. En muchos casos se asocia a la aparición de una fuga tipo 1.
El seguimiento de la evolución de la endoprótesis se realiza mediante angioTAC periódico con el consiguiente riesgo de carcinogénesis (0,02% por TC realizado en pacientes > 50 años) y deterioro de la función renal por el uso de contrastes yodados. La mortalidad perioperatoria de la cirugía endovascular del aneurisma de aorta infrarrenal es baja (1-3%). La tasa de reintervenciones del 18% (76% por vía transfemoral y 24% cirugía abierta).
Fig. 21 Endoprótesis aortouniliaca
Fig. 22 Endoprótesis aortobiilíaca
En resumen, posiblemente la reparación quirúrgica abierta sea mejor en pacientes jóvenes, con poca enfermedad asociada y en los que la durabilidad a largo plazo sea un problema, o en pacientes que no cumplan los requisitos morfológicos para implantar con seguridad una endoprótesis.
En cambio, las endoprótesis serían la mejor opción en pacientes mayores, con múltiples factores de riesgo asociados y con anatomía favorable.
En la siguiente tabla se exponen ventajas e inconvenientes de ambas técnicas:
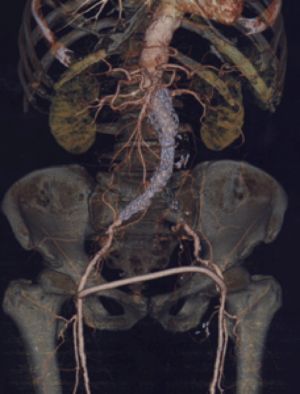
11.4.3 Aneurismas Toracoabdominales
11.4.3.1 Definición
Cuando el segmento enfermo se extiende desde la aorta torácica descendente hasta la aorta abdominal hablamos de ANEURISMAS TORACOABDOMINALES.
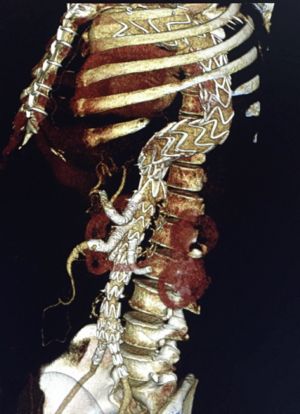
La aorta toracoabdominal tiene unos 40 cm de longitud y un diámetro que oscila entre 23 mm en la porción proximal y 14 mm a nivel de la bifurcación aórtica. Para que consideremos que la aorta es aneurismática debe sobrepasar los 35 mm de diámetro o el doble del diámetro de la aorta adyacente sana. Suponen entre el 5 y 10% de todos los aneurismas aórticos.
Fig. 23 Aneurisma fusiforme. AngioTAC con reconstrucción 3D
11.4.3.2 Etiología
La etiología de estos aneurismas, por orden de frecuencia, es: enfermedad degenerativa de la media (necrosis quística de la media, degeneración mixoide o mixomatosa, aorta senil y síndrome de Marfan), disección aórtica, aterosclerosis, aortitis, infección y traumatismo. Todas estas causas presentan formas macroscópicas o microscópicas específicas pero el resultado final es una dilatación progresiva de la aorta y las manifestaciones clínicas que de ello se derivan.
11.4.3.3 Epidemiología
La supervivencia a los 2 años es del 24%-28% y a los 5 años del 7%-19%. La mitad de las muertes se producen por la ruptura del aneurisma toracoabdominal (5 de cada 100.000 habitantes). Según estos datos en España existen aproximadamente 4.000 personas con este tipo de aneurisma.
La mayoría de estos aneurismas son difusos y fusiformes, excepto los micóticos y los post-traumáticos que suelen ser saculares. Los primeros se presenta en el cayado de la aorta y en el origen de las arterias viscerales en la aorta abdominal, los segundos se detectan a nivel del istmo aórtico, inmediatamente por debajo del origen de la arteria subclavia izquierda.
Fig. 24 Aneurisma sacular. AngioTAC con reconstrucción 3D
11.4.3.4 Clasificación
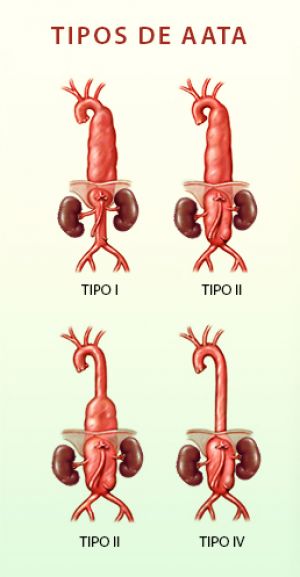
La extensión y forma del aneurisma condiciona la vía de abordaje quirúrgico y la longitud y tipo de sustitución protésica que debe realizarse. La clasificación que mejor adapta los hallazgos morfológicos con la toma de decisiones quirúrgicas es la de Crawford que divide a los aneurismas toracoabdominales en cuatro grupos según su localización:
Tipo I.- Afecta a la aorta torácica descendente y a la porción superior de la aorta abdominal ( 25% ).
Tipo II.- Afecta a la aorta descendente torácica y a casi toda la aorta abdominal (29%).
Tipo III.- Afecta a la porción distal de la aorta torácica descendente y a casi toda la aorta abdominal (23%).
Tipo IV.- Afecta a toda la aorta abdominal, incluida la salida de las arterias viscerales (23%).
Fig. 25. Clasificación de aneurismas toracoabdominales
11.4.3.5 Clínica
Los aneurismas toracoabdominales pueden permanecer asintomáticos durante años pero antes de romperse y producir la muerte pueden presentar: dolor torácico, costal, abdominal o lumbar por compresión de estructuras vecinas y erosión de los cuerpos vertebrales; disnea, tos o neumonitis distal por compresión traqueal o bronquial; hemoptisis por erosión bronquial o pulmonar; disfagia y/o hematemesis por compresión y erosión del esófago; hemorragias digestivas intermitentes o masivas por erosión del duodeno; ictericia por compresión de la vía biliar; ronquera por parálisis del nervio vago secundaria a tracción del nervio recurrente a nivel del cayado; paraparesia o paraplejía en caso de compresiones medulares o por trombosis de las arterias espinales, aunque este síntoma es mas frecuente en las disecciones aórticas; en situaciones poco frecuentes se ha diagnosticado insuficiencia cardiaca aguda por fístula aorto-cava; por último son frecuentes las embolizaciones dístales o las oclusiones crónicas de arterias viscerales.
En nuestra experiencia las presentaciones más frecuentes son asintomáticos, rotos y dolor de espalda o lumbar.
11.4.3.6 Diagnóstico
El diagnóstico suele ser casual ya que tienen escasas manifestaciones clínicas o en la exploración física la parrilla costal impide su palpación.
En la Rx simple de tórax se puede detectar un ensanchamiento mediastínico con bordes calcificados. Los métodos diagnósticos más fiables son la RNM y el TAC ya que nos permiten detectar la localización, tamaño, extensión y relaciones anatómicas de los aneurismas toracoabdominales. Su información es escasa en cuanto a lesiones asociadas (20%) en sus ramas viscerales, pero es posible que el TAC helicoidal con adecuados programas vasculares y reconstrucción 3D aporte información valiosa de estos vasos.
La arteriografía con inyección de contraste a alta presión se utiliza en pacientes seleccionados para valorar la localización de las ramas de la aorta, pero se debe ser especialmente prudente en pacientes con historia de insuficiencia renal ya que el contraste puede empeorarla. Previo a la arteriografía los pacientes deben ser tratados con manitol y sueros.
11.4.3.7 Enfermedades concomitantes
Algo mas de una tercera parte de los pacientes con aneurisma toracoabdominal tiene algún otro aneurisma, especialmente en aorta ascendente y arco aórtico. Teniendo en cuenta la edad de los pacientes es frecuente que presenten enfermedades cardiorrespiratorias e insuficiencia renal y en un 20% de los casos es necesario realizar corrección quirúrgica de lesiones en arterias viscerales. Fístulas aorto-entéricas, aorto-cava, cáncer o úlcus péptico son menos frecuentes pero no excepcionales.
11.4.3.8 Tratamiento
El tratamiento va a depender fundamentalmente del diámetro máximo del aneurisma, de su localización, etiología y de las manifestaciones clínicas. Por debajo de 50 mm de diámetro suelen ser asintomáticos y el riesgo de ruptura es muy bajo e inferior a la morbimortalidad del tratamiento quirúrgico. A partir de 60 mm de diámetro de la posibilidad de que la ruptura del aneurisma sea la causa de muerte del paciente es del 38% en los 2 años siguientes al momento del diagnóstico. Con el tratamiento quirúrgico y en unidades entrenadas y adecuadamente dotadas se consigue supervivencias del 70% y 60% a los 2 y 5 años respectivamente.
Las indicaciones absolutas para el tratamiento quirúrgico son:
- Ruptura
- Síntomas derivados de las compresiones y erosiones de las estructuras vecinas.
- Diámetro mayor de 60 mm en pacientes con síndrome de Marfan y mayores de 65 mm en los que no lo padecen.
• Aumento del diámetro mas de 1 cm al año.
Son contraindicaciones para la cirugía:
- Relativa, tener >80 años
- EPOC severo
• Cáncer con escasa supervivencia
11.4.3.9 Estudios preoperatorios
Posiblemente la cirugía de un aneurisma toracoabdominal sea el mayor desafío técnico y la cirugía más agresiva de toda la patología cardiovascular. Por la edad y por las patologías asociadas arriba mencionadas es imprescindible una cuidadosa valoración de los factores de riesgo de los pacientes para realizar una selección y preparación preoperatoria. en general a todos los pacientes se les realizará:
Espirometría.
Estudio de la función renal.
Eco-Doppler de troncos supraaórticos.
Estudio cardiológico completo: ECG, ecocardio/dobutamina vs talio/dipridamol cardiaco y coronariografía si los estudios previos hacen sospechar algún grado de isquemia coronaria.
Estudio analítico : hemograma, iones, bioquímica y coagulación.
11.4.3.10 Tratamiento quirúrgico
Los pacientes seleccionados serán candidatos al tratamiento quirúrgico. La técnica habitual será la sustitución del aneurisma por una prótesis sintética tubular a la que se reimplantarán las arterias intercostales y viscerales del paciente. En caso de aneurismas saculares no muy extensos puede realizarse la resección del saco aneurismático y el cierre de la aorta mediante un parche sintético.
Durante la cirugía y el postoperatorio gran parte de las medidas técnicas que se adopten serán para prevenir las principales complicaciones de esta intervención: fracaso cardiaco, insuficiencia renal e isquemia medular. Para conseguir minimizar estas complicaciones, fatales en muchos casos, es básico la monitorización operatoria y la actuación anestésica. Todos los pacientes llevarán:
ECG continuo.
Monitorización permanente de presión arterial bilateral.
Accesos venosos central y periféricas de grueso calibre para perfusión rápida de líquidos.
Tubo endotraqueal de doble luz para colapsar el pulmón izquierdo.
Sondaje vesical para diuresis horaria.
Catéter de Swan-Ganz.
Control térmico.
Catéter subaracnoideo lumbar para monitorización de presión de LCR.
Se utilizarán de forma sistemática manta térmica y recuperador celular.
En los últimos tiempos se extiende el uso de ecocardiografía transesofágica peroperatoria en los pacientes con patología cardiaca compleja y medición de potenciales evocados somatosensoriales para detectar signos precoces de isquemia medular.
Una vez monitorizado al paciente se coloca en decúbito lateral derecho y se realiza una toraco-freno-laparotomía para poder abordar y controlar toda la aorta torácica descendente y abdominal. El nivel y extensión de la incisión dependerá del tipo de aneurisma (clasificación de Crawford antes mencionada). Una vez controlada la aorta se procede al clampaje de la misma y a la sustitución protésica. Existen distintas escuelas que abogan por métodos diferentes para evitar la isquemia medular y renal durante este tiempo. Aquellos que calculan que el clampaje aórtico no superará los 30 minutos no suele realizar ningún método de protección, si se va a superar este tiempo algunos son partidarios de soportes parciales con derivaciones entre aurícula izquierda y arteria femoral, otros son partidarios de hipotermia profunda y parada circulatoria o de utilizar derivaciones heparinizadas como el shunt de Gott, etc... en todo caso estas técnicas dependen del tipo de aneurisma y de la habilidad técnica del equipo quirúrgico.
Fig. 26. Aspecto quirúrgico de la cirugía aorta torácica abierta
En los últimos años se está investigando opciones de tratamientos menos agresivos mediante procedimientos endovasculares puros o “híbridos”, mezcla de cirugía abierta y endovascular. Los resultados parecen prometedores pero aún estamos lejos de procedimientos seguros, con baja tasa de complicaciones y duraderos en el tiempo.
Fig. 27 Tratamiento endovascular de AATA
11.4.3.11 Resultados
La mortalidad hospitalaria oscila entre el 6 y el 12% en la cirugía electiva, del 20-22% en la cirugía urgente y más del 50% en los aneurismas rotos.
En cuanto a la morbilidad asociada una tercera parte de los pacientes precisan intubación prolongada.
La insuficiencia renal está presente entre el 4 y el 40% de los casos, dependiendo de la serie consultada, pero el factor de mal pronóstico es la necesidad de diálisis ya que la mitad de ellos fallecen.
La isquemia medular con paraparesia o paraplejía asociada se presenta entre el 4 y el 27% de los operados aunque las medidas de protección medular que se utilizan en los últimos años parece que nos acercan al margen inferior del abanico.
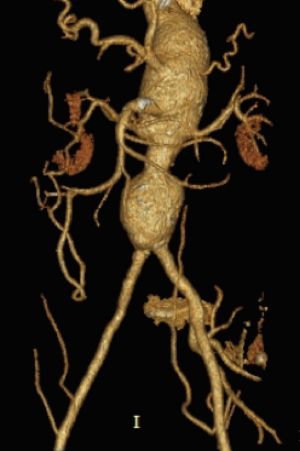
11.5 Aneurismas de las Ramas Viscerales de la Aorta.
Los aneurismas de las arterias viscerales pueden localizarse en cualquier rama importante de la aorta y son infrecuentes pero pueden ser devastadores. El 22% se presentan como urgencia clínica y un 8,5% acaba en fallecimiento del paciente.
Los factores de riesgo son la aterosclerosis, la hipertensión arterial, el tabaquismo y la edad avanzada. La infección localizada puede conducir al desarrollo de aneurismas micóticos.
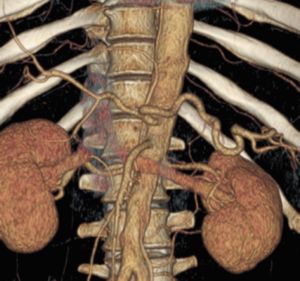
Fig. 28Anatomía normal de aorta abdominal y a. viscerales
Alrededor del 60% de los aneurismas de este tipo se encuentran en la arteria esplénica, el 20% en la arteria hepática y el 5,5% en la arteria mesentérica superior, el 4% en el tronco celíaco y el resto se distribuyen entre el resto de las ramas colaterales de estas arterias. En muchos casos se localizan en anomalías anatómicas de las arterias viscerales. En un tercio de los casos se asocian a aneurisma de aorta.
11.5.1 Arteria esplénica
Los aneurismas en la arteria esplénica son los más frecuentes y en las mujeres más que en los hombres (4:1).
Las causas incluyen displasia fibromuscular de la media, hipertensión portal, embarazos múltiples, traumatismos penetrantes o no penetrantes, pancreatitis e infección.
Los aneurismas esplénicos de gran tamaño suelen ser saculares. Se localizan sobre todo en bifurcaciones y son múltiples en el 20% de los casos.
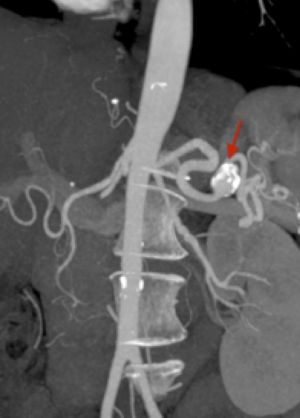
Se diagnostican por Rx simples de abdomen en los que se observan calcificaciones curvilíneas en forma de anillo de sello en hipocondrio izquierdo. Con mayor frecuencia se diagnostican por estudios ecográficos, TC, RNM o angiografías abdominales ya que la inmensa mayoría son asintomáticos. Casi nunca alcanzan los 2 cm de diámetro y rara vez son palpables. La forma mas grave de presentación es por hemorragia abdominal masiva tras rotura del aneurisma. Es frecuente esta presentación en embarazadas ( mortalidad 70% frente al 25% en las no embarazadas rotos).
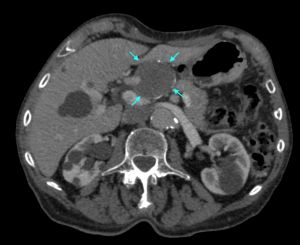
Fig. 29 Aneurisma esplénico. AngioTAC
El tratamiento quirúrgico está indicado en los aneurismas esplénicos sintomáticos, en aquellos mayores de 2 cm y con estado general que garantice una mortalidad perioperatoria inferior al 2%. La técnica habitual es la ligadura de la arteria esplénica proximal y distal al aneurisma. En pacientes que puedan tener un riesgo superior es recomendable la embolización percutánea.
11.5.2 Arteria hepática
Los aneurismas de la arteria hepática suponen el 20% de los aneurismas de arterias viscerales, son más frecuentes en los hombres que en las mujeres (2:1) y pueden ser secundarios a un traumatismo abdominal previo (22%), drogadicción intravenosa (10%), degeneración de la capa media de la pared arterial (24%) o inflamación periarterial aunque no se conoce realmente cuales son los fenómenos específicos que producen el aneurisma. Los aneurismas de la arteria hepática pequeños suelen ser fusiformes y los mayores de 2 cm saculares. La mayoría son solitarios y extrahepáticos.
Fig. 30 Aneurisma arteria hepática. Arteriografía selectiva
La mayoría de los casos se diagnostican en pacientes alrededor de 50 años y asintomáticos. Los sintomáticos solo suelen presentar dolor vago y persistente en epigastrio o hipocondrio derecho y sin relación con las comidas. La ecografía y el TAC son útiles en el diagnóstico de pacientes con sospecha de aneurisma hepático.
Dado que el 20-44% de los pacientes no tratados acaba con rotura del aneurisma y ésta tiene una mortalidad del 35% parece conveniente adoptar una actitud agresiva en el tratamiento.
Habitualmente se procede a la ligadura del aneurisma y en caso en que pueda existir sufrimiento hepático se procede a revascularización con by-pass de vena safena preferentemente.
11.5.3 Arteria mesentérica superior
Los aneurismas de la arteria mesentérica superior representan el 5’5% de los aneurismas viscerales. Suelen afectar a los 5 cm iniciales del tronco de la mesentérica superior y la causa más frecuente parece ser infecciosa secundaria a estreptococo no hemolítico de origen en endocarditis izquierda seguidos por los de origen aterosclerótico. Igual proporción de hombres y mujeres.
Fig. 31Aneurisma de arteria mesentérica superior
Rara vez son asintomáticos, los de origen infeccioso suelen manifestarse antes de los 50 años y los ateroscleróticos a partir de la década de los 60. Pueden presentarse con dolor epigástrico intenso y persistente y a medida que aumentan de tamaño pueden presentar cuadros de ángor intestinal. En la actualidad casi un 40% evolucionan a rotura. Es frecuente la palpación de una masa abdominal pulsátil dolorosa a la palpación.
La mayoría de los casos se detectan en Rx abdominales y angiografías realizadas por otros motivos.
El tratamiento es principalmente quirúrgico: ligadura, aneurismorrafia, by-pass con vena safena o prótesis, embolizaciones y stent recubierto por vía percutánea han sido propuestos. La mortalidad quirúrgica es de un 15%. Es preciso además antibioterapia durante largo tiempo en los que se sospeche un origen infeccioso.
11.5.4 Tronco celiaco
Son infrecuentes y representan el 4% de todos los aneurismas viscerales. La aterosclerosis y la degeneración de la media son las causas más frecuentes. El 18% se asocia a aneurismas aórticos y el 38% a otros aneurismas viscerales.
La mayoría son asintomáticos, en igual proporción hombre: mujer y de media suelen se diagnóstica en torno a los 40 años. Cuando presentan síntomas se manifiestan con dolor epigástrico intenso, irradiado a espalda y asociado a náuseas y vómitos que hay que diferenciar de la pancreatitis. A la exploración puede existir soplo abdominal y en un 30% masa pulsátil palpable. La presencia de ángor es rara y si aparece es por asociación a lesiones ateroscleróticas en las otras arterias viscerales. El riesgo de rotura es del 13%.
El diagnóstico suele ser casual al realizar estudios radiológicos abdominales.
El tratamiento quirúrgico de elección es resección del aneurisma y reconstrucción vascular. En una tercera parte de los casos se realizó ligadura del aneurisma. La mortalidad quirúrgica electiva es del 15% y cuando el aneurisma está roto del 40%.
Fig. 32 Aneurisma del Tronco Celíaco. AngioTAC
11.6 Aneurismas de la Extremidad Superior
11.6.1 Arteria subclavia
Las causas mas frecuentes son las degenerativas y las estenosis en el desfiladero torácico. Otras causas menos habituales son la displasia fibromuscular, sífilis, necrosis quística de la media , tuberculosis o congénitas. En el 30-50% de los de etiología aterosclerótica se asocian a aneurismas aórticos.
La edad de presentación es a partir de los 60 años y es ligeramente mas frecuente en hombres.
La sintomatología de presentación suele ser:
1.- Dolor cervical o cintura escapular homolateral (en casos de expansión brusca o rotura).
2.- Isquemia aguda o crónica en la extremidad asociada a trombosis o embolismo.
3.- Dolor en miembro superior y alteraciones neurológicas por compresión del plexo braquial.
4.- Ronquera por compresión del nervio laríngeo recurrente derecho.
5.- Insuficiencia respiratoria por compresión traqueal.
6.- AIT o ictus por embolización hacia territorio vertebral o retrógradamente hacia carótida derecha.
7.- Hemoptisis por erosión del vértice pulmonar.
8.- Pacientes asintomáticos pueden acudir al notar una tumoración pulsátil supraclavicular (es importante no confundir con simples elongaciones de estos vasos).
A la exploración, además de la posible masa pulsátil , se puede encontrar soplo clavicular, disminución o ausencia de pulsos distales al aneurisma, signos de microembolismos en dedos de la mano, alteraciones sensitivas o motoras en territorio del plexo braquial, parálisis de cuerdas vocales y síndrome de Horner por compresión del ganglio estrellado.
La RX simple, eco-doppler y AngioTAC son métodos diagnósticos adecuados. La angiografía puede ser necesaria si existe sospecha de embolización distal o para planificación quirúrgica.
Fig. 33 Arteriografía. Aneurisma subclavio derecho
El tratamiento en los segmentos proximal e intermedio de la arteria subclavia consiste en la resección quirúrgica del aneurisma y sustitución por una prótesis sintética. En el segmento distal subclavio-axilar, donde se produce un pinzamiento entre clavícula y primera costilla, suele ser necesario además la resección de esta primera costilla. En los últimos años , en casos adecuados o en pacientes con otras complicaciones severas asociadas, se ha introducido la colocación de prótesis endovasculares por vía percutánea. En general los resultados a largo plazo en la cirugía son óptimos.
11.6.2 Arteria subclavio-axilar
Son más frecuentes en pacientes jóvenes y mujeres. Casi siempre van asociados a la presencia de costilla cervical. Son más frecuentes en el lado derecho.
El aneurisma se produce por compresión entre la costilla cervical y la primera costilla, especialmente cuando la costilla cervical es completa y se encuentra unida a la 1ª costilla. Esta compresión produce una dilatación postestenótica que evoluciona progresivamente hasta dar lugar a un aneurisma. El trombo intraluminal del aneurisma puede desprenderse y embolizar distalmente. También es frecuente encontrar la trombosis completa del aneurisma.
La sintomatología de presentación es:
1.- Dolor cervical o cintura escapular homolateral (en casos de expansión brusca o rotura).
2.- Isquemia aguda o crónica en la extremidad asociada a trombosis o embolismo.
3.- Dolor en miembro superior y alteraciones neuróticas por compresión del plexo braquial.
4.- Síndrome de Raynaud.
En la exploración a veces puede palparse la costilla cervical. El resto de la exploración es similar a la de los aneurismas subclavios.
El diagnóstico se debe realizar con Rx columna cérvicodorsal, RNM del desfiladero torácico y AngioTAC o angiografía para conocer la extensión del aneurisma. El eco-doppler es adecuado para diagnosticar el aneurisma pero debe complementarse con el resto de los estudios antes mencionados.
El tratamiento consiste en la resección completa de la costilla cervical, del músculo escaleno anterior y del aneurisma con sustitución por prótesis vascular. En los casos que exista un aneurisma en esta localización sin costilla cervical es recomendable la resección parcial de la primera costilla.
11.6.3 Arteria subclavia aberrante o divertículo de Kommerell
Es la anomalía anatómica mas frecuente del cayado aórtico. Consiste en que la arteria subclavia derecha surge de la parte proximal de la aorta descendente cruzando por delante del esófago.
En la mayoría de los casos esta anomalía no tiene ninguna repercusión clínica pero un 20% de los casos degenera en aneurisma.
La sintomatología puede consistir en disfagia por compresión del esófago o tos por compresión traqueal. Existe el riesgo de rotura y muerte.
El diagnóstico se realiza mediante AngioTAC y angiografía.
El tratamiento es quirúrgico con anulación de la arteria aberrante y revascularización de la subclavia.
11.6.4 Aneurisma axilar
Salvo raros casos de origen congénito la mayoría son secundarios a traumatismos cerrados (muletas) o abiertos.
Se caracterizan por un trombo poco adherido a la íntima y fácilmente desprendible, por lo que la clínica suele ser embolígena.
El tratamiento es quirúrgico con resección del aneurisma y sustitución por un by-pass de vena safena.
11.6.5 Aneurisma cubital
Produce el llamado síndrome de la eminencia hipotenar. Se presenta en varones de mediana edad y trabajadores manuales. Con menor frecuencia puede erse en mujeres y jóvenes.
La arteria y nervio cubital penetran en la mano a través del canal de Guyon, donde se forma un túnel de suelo óseo (huesos pisiforme y ganchoso) y un techo blando formado por la aponeurosis palmar y el músculo palmar corto. Esta situación hace que la arteria sea muy vulnerable a pequeños traumatismos continuados, ya que a final del túnel la arteria se ramifica en las dos ramas que forman los arcos palmares profundo y superficial que la inmovilizan.
Los traumatismos de esta zona de la arteria cubital acaban provocando trombosis intimal y aneurisma verdadero en la media. Algunos autores opinan que estas lesiones se producen por un displasia fibromuscular preexistente. La sintomatología se produce por microembolización hacia las arterias digitales. El síndrome de Raynaud puede ser el principal síntoma pero se caracteriza por ser unilateral, no afectar al 1º dedo y no tener la típica fase de hiperemia reactiva.
A la exploración, aparte de las lesiones isquémicas digitales secundaria a la trombosis o microembolización, podemos encontrar hipersensibilidad en la eminencia hipotecar con un masa pulsátil o no. También podemos encontrar atrofia muscular y alteraciones sensitivas en territorio cubital.
Fig. 34 Arteriografía. Aneurisma arteria cubital
El tratamiento ideal es resección del aneurisma y reconstrucción vascular. A veces hay que asociarlo a simpatectomía cervicotorácica, tratamiento trombolítico o betabloqueantes, dependiendo del grado de lesión digital y trombosis de arcos palmares.
11.7 Aneurismas de la Extremidad Inferior
11.7.1 Ilíaco aislado
Son raros y con una prevalencia del 0.03%. Más frecuente en varones (5:1) a partir de los 60 años. Se afectan principalmente la ilíaca común (70-90%) e interna (10-30%) y excepcionalmente la externa. El 50% son bilaterales.
Generalmente son asintomáticos salvo los casos de rotura. En caso de ser sintomáticos es por compresión de estructuras vecinas: obstrucción ureteral, hematuria, trombosis vena ilíaca, obstrucción de intestino grueso o alteraciones neurológicas en la extremidad inferior.
A la exploración física son indetectables salvo en pacientes delgados o en aneurismas de gran tamaño. Se diagnostican muchas veces de forma casual, por estudios ecográficos,
Fig. 35 Arteriografía. Aneurisma iliaco izquierdo
El tratamiento de elección es quirúrgico, tanto cirugía abierta como endovascular, a partir de los 3 cm de diámetro. La mortalidad en la cirugía programada es <5% y en los rotos entre el 25-57%.
11.7.2 Femoral común
Se considera que una arteria femoral común es aneurismática a parir de 15-20 mm. Son poco frecuentes, más en hombres (28:1) y mayores de 55 años. El 75% de los casos presenta simultáneamente aneurisma de aorta abdominal y en una tercera parte de los casos un aneurisma poplíteo. En un 56% de los casos puede afectar al origen de la arteria femoral profunda.
Se consideran mayoritariamente de etiología degenerativa.
Suelen ser asintomáticos pero los de gran tamaño pueden producir edema (compresión vena femoral) o dolor y parestesias (compresión nerviosa). Pueden complicarse (2,9%) con trombosis, embolización o rotura y se relacionan con el tamaño y el contenido trombótico, en general se presentan raramente por encima de los 50 mm de diámetro.
Aunque la arteria es fácilmente palpable solo se diagnosticaron una cuarta parte de los aneurismas femorales comunes por la exploración física. El eco-doppler muestra con precisión la localización, extensión, diámetro y contenido de material trombótico en estos aneurismas. El AngioTAC también permite determinar estos datos. Es conveniente explorar simultáneamente aorta y poplítea por la posible presencia de aneurismas concomitantes.
Se indica la intervención quirúrgica a partir de 25 mm de diámetro. Normalmente se realiza la resección del aneurisma y sustitución por prótesis sintética.
11.7.3 Femoral profunda
Son raros y representan el 0,5% de todos los aneurismas periféricos y aún más raros si solo afectan a la femoral profunda. Generalmente se diagnostican solo si presentan complicaciones ( rotura o trombosis ). La ecografía y el AngioTAC son los métodos diagnósticos de elección.
El tratamiento es siempre quirúrgico con revascularización de la arteria y de las ramas principales. En casos poco abordables puede optarse por ligadura del aneurisma o embolización.
11.7.4 Femoral superficial
Estos aneurismas, de forma aislada y sin asociación a aneurismas de femoral común o poplítea, son raros y representan menos del 1% de los aneurismas femorales.
Se presentan en varones, de origen degenerativo y la mayoría debutan con cuadro de isquemia crítica o masa dolorosa en muslo. Se recomienda tratamiento quirúrgico mediante resección y sustitución por una prótesis o by-pass de vena safena. Cada vez mas se tratan por vía endovascular mediante endoprótesis recubierta.
11.7.5 Aneurismas poplíteos
La arteria poplítea tiene un diámetro medio, en nuestra población, de 7 mm. Se considera aneurisma a partir de 15-20 mm.
Son los aneurismas de arterias periféricas más frecuentes (70%). En un 36% de los casos coexiste un aneurisma aorta abdominal ( por el contrario solo entre el 6-12% de los aneurismas de aorta presentan simultáneamente un aneurisma poplíteo ).
Aproximadamente se diagnostica a partir de los 65 años, en varones (95%), bilaterales (50%) y los unilaterales acaban desarrollando aneurisma contralateral en la mitad de los pacientes en los 10 años siguientes.
Son aneurismas de tipo degenerativo con actividad enzimática proteolítica en sus paredes, también puede asociarse a compresión crónica de la arteria poplítea.
Fig. 36 Esquema aneurisma poplíteo. Arteriografía
La presentación clínica habitual es : asintomáticos (37%), isquemia de la extremidad (55%), compresión local (6,5%) y rotura (1,4%). Existe una correlación entre tamaño y sintomatología, así los de 2 cm suelen ser asintomáticos y los de 3 cm se asocian a síntomas isquémicos. El riesgo de rotura aumenta con el diámetro.
En la exploración física hay que sospechar aneurisma poplíteo cuando el pulso poplíteo sea expansivo o si se detecta una masa en hueco poplíteo con ausencia de pulso. Es importante la exploración de los pulsos distales ya que su presencia o ausencia tiene valor pronóstico.
La sospecha clínica y la exploración física deben ser confirmadas mediante estudio eco-doppler y/o AngioTAC. En ellos se valorará localización, extensión, diámetro, flujo, contenido trombótico y vascularización distal. En ocasiones es imprescindible realizar estudios angiográficos. Son fundamentales para planificar el tratamiento.
La evolución natural de los aneurismas poplíteos >20 mm sin tratamiento quirúrgico fue de isquemia de la extremidad (24% en el primer año y 36% a los tres años si en el momento del diagnóstico tenían pulsos distales frente al 86% cuando no los tenían). La tasa de amputación de estos pacientes fue del 24%.
Son muy poco frecuentes y se localizan contralateral en la mitad de los pacientes en los 10 años siguientes.
El tratamiento consiste en ligadura del aneurisma y reconstrucción con by-pass, preferentemente de vena safena interna. En los últimos años se ha desarrollado la técnica de exclusión del aneurisma mediante una endoprótesis pero sus resultados son francamente peores que los del by-pass.
En casos que la presentación clínica sea una isquemia aguda por trombosis del aneurisma se puede realizar trombolisis intrarterial percutánea previa a la cirugía para repermeabilizar los troncos distales y mejorar el resultado de la intervención.
Los resultados del tratamiento son mucho mejores en los aneurismas asintomáticos que en los sintomáticos agudos o crónicos y en aquellos en que la cirugía fue programada frente a los que precisaron cirugía urgente.
Fig. 37 Exclusión quirúrgica de un aneurisma poplíteo mediante by-pass
11.8 Aneurismas Carotideos Extracraneales
Se localizan preferentemente en bifurcación carotídea, carótida interna y carótida externa. Antiguamente su causa mas frecuente eran infecciones (sífilis, tuberculosis,…) pero actualmente se relacionan mas con disección (sobre displasia fibromuscular o por yatrogenia), aterosclerosis (40%), traumatismos (seudoaneurismas) y cirugías carotídeas (infecciones por estafilococo tras endarterectomía cerrada con parche sintético). Otras causas mas raras pueden ser la necrosis quística de la media, el síndrome de Marfan, la arteritis de Takayasu y la arteriopatía medial idiopática.
La mayoría de los aneurismas localizados en la bifurcación son fusiformes y los localizados en carótida interna saculares.
No se conoce la evolución natural de estos aneurismas pero algunos estudios indican hasta un 50% de ictus en los aneurisma ateroscleróticos no tratados.
La sintomatología varía según tamaño, localización y etiología. Los pequeños aneurismas pueden permanecer asintomáticos pero el resto se presenta como una masa cervical pulsátil a nivel submandibular, creciendo hacia la faringe y fosa amigdalina. El dolor es el síntoma más frecuente (40%), la disfagia se produce en aneurismas de gran tamaño o por compresión de los nervios faríngeos, también pueden comprimir localmente los nervios de la zona y producir dolor facial intenso, parálisis de los pares craneales V y VI, sordera y síndrome de Horner. La compresión del vago produce ronquera. En un 40% de los pacientes se producen AIT o ictus. La hemorragia es una complicación rara.
El diagnóstico diferencial hay que hacerlo fundamentalmente con las elongaciones y bucles de la carótida común que dan lugar a una masa pulsátil cervical (derechos, mujeres, obesas, mayores e hipertensas).
La mayoría de los diagnósticos diferenciales pueden resolverse mediante eco-doppler pero en casos de sospecha de aneurisma de la carótida interna extracraneal alto es necesario el
concurso de un angioTAC, angioRNM o arteriografía.
Fig. 38 AngioTAC. Aneurisma carótida interna
Técnicas que se usaron inicialmente como la ligadura del vaso, la envoltura o la aneurismorrafia han sido abandonadas y sustituidas por la resección y revascularización (sutura termino-terminal directa, by-pass,…), preferentemente en la zona accesible de la carótida común y el tercio proximal de la interna ( tasa combinada de riesgo de muerte mas ictus del 10%).
Fig. 39 Arteriografía. Aneurisma carótida interna
Dado el riesgo de lesiones de nervios periféricos en la reparación quirúrgica de los aneurismas altos de carótida interna es preferible, si técnicamente es posible, el tratamiento endovascular mediante embolización del saco del aneurisma o colocación de endoprótesis.
Fig. 40 Resección aneurisma y anastomosis T-T
11.9 Bibliografía
1. Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
2. Cirugía Vascular. Sexta Edición. Rutherford. Elservier Saunders 2006
3. Management of Abdominal Aortic Aneurysm. Clinical Practice Guidelines of the ESVS. Vol 41, Supplement 1 Jaunary 2011.
4. Advanced TEVAR: Data Update y Technical Tips. Journal of Vascular Surgery Vol 52, Supplement 8, October 2010.
5. The care of patients with an abdominal aortic aneurysm: The Society for Vascular Surgery practice guidelines Elliot L. Chaikof, MD, PhD,a David C. Brewster, MD,b Ronald L. Dalman, MD,c Michel S. Makaroun, MD,d Karl A. Illig, MD,e Gregorio A. Sicard, MD,f Carlos H. Timaran, MD,g Gilbert R. Upchurch Jr, MD,h and Frank J. Veith, MD,i Atlanta, Ga, Boston, Mass, Palo Alto, Calif, Pittsburgh, Penn, Rochester, NY, St. Louis, Mo, Dallas, Tex, Ann Arbor, Mich, and Cleveland, Ohio. Journal of Vascular Surgery. Supplement . October 2009.
6. ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the Diagnosis and Management of Patients WithThoracic Aortic Disease: Executive Summary. Loren F. Hiratzka, MD; George L. Bakris, MD; Joshua A. Beckman, MD, MS; Robert M. Bersin, MPH, MD; Vincent F. Carr, DO; Donald E. Casey, MD, MPH, MBA; Kim A. Eagle, MD; Luke K. Hermann, MD; Eric M. Isselbacher, MD; Ella A. Kazerooni, MD, MS; Nicholas T. Kouchoukos, MD; Bruce W. Lytle, MD; Dianna M. Milewicz, MD, PhD; David L. Reich, MD; Souvik Sen, MD, MS; Julie A. Shinn, RN, MA, CCRN; Lars G. Svensson, MD, PhD; David M. Williams, MD. Copyright 2010, American College of Cardiology Foundation and the American Heart Association, Inc.. All Rights Reserved. J Am Coll Cardiol. 2010;55(14):1509-1544.
7. Archer C, Wynn M. Outcomes in open repair of the thoracic and thoracoabdominal aorta. J Vasc Surg 2010, 3S-9S
8. Management of abdominal aortic aneurysm. Clinical Practice Guidelines of the European Society for Vascular Surgery. 2011, 41, suppl 1
9. Eslami MH, messina L. Ruptured AAA: Open surgical management Seminars in Vascular Surgery 23:200-205. 2010
10. Mehta M, Kreienberg P, Roddy S, Paty P, et al. Ruptured abdominal aortic aneurysm: Endovascular programe development and resulte. Seminars in Vascular Surgery 23:206-205. 2014
11. Starr J, Halpern V. Abdominal aortic aneurysm in womwn, J Vasc Surg 57:3S-10S. 2013
12. Hultgren R, Larsson E,Wahlgren CM, Swedenborg J. Female and elderly abdominal aortic aneurysm patients more commonly have concurrent thoracic aortic aneurysm. Ann Vasc Surg 2012;26:918–923.
13. Chaer RA, Vasoncelos R, Marone LK, Al-Khoury G, RheeRY,ChoJS, Makaroun S. Synchronous and metachronous thoracic aneurysms in patients with abdominal aortic aneurysms. J Vasc Surg 2012;56:1261–1265.
14. AboyansV, Criqui MH, Abraham P, Allison MA, Creager MA, Diehm C, Fowkes FG, Hiatt WR, Jonsson B, Lacroix P, Marin B, McDermott MM, Norgren L, Pande RL, Preux PM, Stoffers HE, Treat-Jacobson D. Measurement and interpretation of the ankle-brachial index: a scientific statement from the American Heart Association. Circulation 2012;126:2890–2909.
15. Lee JJ, Dimick JB, Williams DM, Henke PK, Deeb GM, Eagle KA, Stanley JC, UpchurchGR Jr. Existence of abdominal aortic aneurysms in patients with thoracic aortic dissections. J Vasc Surg 2003;38:671–675.
16. Diwan A, Sarkar R, Stanley JC, Zelenock GB,WakefieldTW. Incidence of femoral and popliteal artery aneurysms in patients with abdominal aortic aneurysms. J Vasc Surg 2000;31:863–869.
17. Karthikesalingam A, Bahia SS, Patterson BO, Peach G, Vidal-Diez A, Ray KK, Sharma R, Hinchliffe RJ, Holt PJ, Thompson MM. The shortfall in long-termsurvival of patients with repaired thoracic or abdominal aortic aneurysms: retrospective case-control analysis of hospital episode statistics. Eur J Vasc Endovasc Surg 2013; 46:533–541.
18. Joint Task Force on the Management of Valvular Heart Disease of the European Society of C, European Association for Cardio-Thoracic S, Vahanian A, Alfieri O, Andreotti F, Antunes MJ, Baron-Esquivias G, Baumgartner H, Borger MA, Carrel TP, De Bonis M, Evangelista A, Falk V, Iung B, Lancellotti P, Pierard L, Price S, Schafers HJ, Schuler G, Stepinska J, Swedberg K, Takkenberg J, Von Oppell UO, Windecker S, Zamorano JL, Zembala M. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012;33:2451–2496.
19. Schaefer BM, Lewin MB, Stout KK, Gill E, Prueitt A, Byers PH, Otto CM. The bicuspid aortic valve: an integrated phenotypic classification of leaflet morphology and aortic root shape. Heart 2008;94:1634–1638.
20. Albornoz G, Coady MA, Roberts M, Davies RR, Tranquilli M, Rizzo JA, Elefteriades JA. Familial thoracic aortic aneurysms and dissections: incidence, modes of inheritance, and phenotypic patterns. Ann Thorac Surg 2006;82: 1400–1405.
21. Kuzmik GA, Sang AX, Elefteriades JA. Natural history of thoracic aortic aneurysms. J Vasc Surg 2012;56:565–571.
22. Detaint D, Michelena HI, Nkomo VT, Vahanian A, Jondeau G, Sarano ME. Aortic dilatation patterns and rates in adults with bicuspid aortic valves: a comparative study with Marfan syndrome and degenerative aortopathy. Heart 2014;100: 126–134.
23. Elefteriades JA. Indications for aortic replacement. J Thorac Cardiovasc Surg 2010; 140:S5–S9; discussion S45–S51.
24. Kari FA, Russe MF, Peter P, Blanke P, Rylski B, EuringerW, Beyersdorf F, Siepe M. Late complications and distal growth rates of Marfan aortas after proximal aortic repair. Eur J Cardiothorac Surg 2013;44:163–171.
25. Jondeau G, Detaint D, Tubach F, Arnoult F, Milleron O, Raoux F, Delorme G,Mimoun L, Krapf L, Hamroun D, Beroud C, Roy C, Vahanian A, Boileau C. Aortic event rate in the Marfan population: a cohort study. Circulation 2012;125:226–232.
26. Loeys BL, Schwarze U, Holm T, Callewaert BL, Thomas GH, Pannu H,De Backer JF, Oswald GL, Symoens S, Manouvrier S, Roberts AE, Faravelli F, Greco MA, Pyeritz RE, Milewicz DM, Coucke PJ, Cameron DE, Braverman AC, Byers PH, Paepe AM, Dietz HC. Aneurysm syndromes caused by mutations in the TGF-beta receptor. N Engl J Med 2006;355:788–798.
27. Attias D, Stheneur C, Roy C, Collod-Beroud G, Detaint D, Faivre L, Delrue MA, Cohen L, Francannet C, Beroud C, Claustres M, Iserin F, Khau Van Kien P, Lacombe D, Le Merrer M, Lyonnet S, Odent S, Plauchu H, Rio M, Rossi A, Sidi D, Steg PG, Ravaud P, Boileau C, Jondeau G. Comparison of clinical presentations and outcomes between patients with TGFBR2 and FBN1 mutations in Marfan síndrome and related disorders. Circulation 2009;120:2541–2549.
28. Michelena HI, Khanna AD, Mahoney D, Margaryan E, Topilsky Y, Suri RM, Eidem B, EdwardsWD,SundtTM3rd, Enriquez-Sarano M. Incidence of aortic complications in patients with bicuspid aortic valves. JAMA 2011;306:1104–1112.
29. Gravholt CH, Landin-Wilhelmsen K, Stochholm K, Hjerrild BE, Ledet T, Djurhuus CB, Sylven L, Baandrup U, Kristensen BO, Christiansen JS. Clinical and epidemiological description of aortic dissection in Turner’s syndrome. Cardiol Young 2006;16:430–436.
30. Chiesa R, Melissano G, Tshomba Y, Civilini E, Marone EM, Bertoglio L, Calliari FM. Ten years of endovascular aortic arch repair. J Endovasc Ther 2010;17:1–11.
31. Cochennec F, Tresson P, Cross J, Desgranges P, Allaire E, Becquemin JP. Hybrid repair of aortic arch dissections. J Vasc Surg 2013;57:1560–1567.
32. Walsh SR, Tang TY, Sadat U, Naik J, Gaunt ME, Boyle JR, Hayes PD, Varty K. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. J Vasc Surg 2008;47:1094–1098.
33. Cheng D, Martin J, Shennib H, Dunning J, Muneretto C, Schueler S, Von Segesser L, Sergeant P, Turina M. Endovascular aortic repair versusopen surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. J Am Coll Cardiol 2010;55:986–1001.
34. Bavaria JE, Appoo JJ, Makaroun MS, Verter J, Yu ZF, Mitchell RS. Endovascular stent grafting versus open surgical repair of descending thoracic aortic aneurysms in low-risk patients: a multicenter comparative trial. J Thorac Cardiovasc Surg 2007; 133:369–377.
35. Makaroun MS, Dillavou ED, Wheatley GH, Cambria RP. Five-year results of endovascular treatment with the Gore TAGdevice compared with open repair of thoracic aortic aneurysms. J Vasc Surg 2008;47:912–918.
36. Goodney PP, Travis L, Lucas FL, Fillinger MF, Goodman DC, Cronenwett JL, Stone DH. Survival after open versus endovascular thoracic aortic aneurysm repair in an observational study of the Medicare population. Circulation 2011;124:2661–2669.
37. Shah AA, Barfield ME, Andersen ND, Williams JB, Shah JA, Hanna JM, McCann RL, Hughes GC. Results of thoracic endovascular aortic repair 6 years after United States Food and Drug Administration approval. Ann Thorac Surg 2012;94:1394–1399.
38. Patterson B, Holt P, Nienabe C, Cambria R, Fairman R, Thompson M. Aortic pathologydetermines midterm outcome after endovascular repair of the thoracic aorta: report from the Medtronic Thoracic Endovascular Registry (MOTHER) database. Circulation 2013;127:24–32.
39. Dumfarth J, Michel M, Schmidli J, Sodeck G, Ehrlich M, Grimm M, Carrel T, Czerny M. Mechanisms of failure and outcome of secondary surgical interventions after thoracic endovascular aortic repair (TEVAR). Ann Thorac Surg 2011;91:1141–1146.
40. Waterman AL, Feezor RJ, Lee WA, Hess PJ, Beaver TM, Martin TD, Huber TS, BeckAW. Endovascular treatment of acute and chronic aortic pathology in patients with Marfan syndrome. J Vasc Surg 2012;55:1234–1240; discussion 1240–1241.
41. CooperDG,Walsh SR, Sadat U, Hayes PD, Boyle JR. Treating the thoracic aorta in Marfan syndrome: surgery or TEVAR? J Endovasc Ther 2009;16:60–70.
42. Golledge J, Muller J, Daugherty A, Norman P. Abdominal aortic aneurysm: pathogenesis and implications for management. Arterioscler Thromb Vasc Biol 2006;26:2605–2613.
43. Ogata T, MacKean GL, Cole CW, Arthur C, Andreou P, Tromp G, Kuivaniemi H. The lifetime prevalence of abdominal aortic aneurysms among siblings of aneurysm patients is eightfold higher than among siblings of spouses: an analysis of 187 aneurysm families in Nova Scotia, Canada. J Vasc Surg 2005;42:891–897.
44. Hemminki K, Li X, Johansson SE, Sundquist K, Sundquist J. Familial risks of aortic aneurysms among siblings in a nationwide Swedish study. Genet Med2006;8:43–49.
45. Larsson E, Granath F, Swedenborg J, Hultgren R. A population-based case-control study of the familial risk of abdominal aortic aneurysm. J Vasc Surg 2009;49:p47–50; discussion 51.
46. Badger SA, Jones C, McClements J, Lau LL, Young IS, Patterson CC. Surveillance strategies according to the rate of growth of small abdominal aortic aneurysms. Vasc Med 2011;16:415–421.
47. Takagi H, Goto SN, Matsui M, Manabe H, Umemoto T. A further meta-analysis of population-based screening for abdominal aortic aneurysm. J Vasc Surg 2010;52:1103–1108.
48. Stather PW, Dattani N, Bown MJ, Earnshaw JJ, Lees TA. International variations in AAA screening. Eur J Vasc Endovasc Surg 2013;45:231–234.
49. Shreibati JB, Baker LC, Hlatky MA, Mell MW. Impact of the Screening Abdominal Aortic Aneurysms Very Efficiently (SAAAVE) Act on abdominal ultrasonography use among Medicare beneficiaries. Arch Intern Med 2012;172:1456–1462.
50. Svensjo S, Bjorck M, Gurtelschmid M, Djavani Gidlund K, Hellberg A,Wanhainen A. Low prevalence of abdominal aortic aneurysm among 65-year-old Swedish men indicates a change in the epidemiology of the disease. Circulation 2011;124:1118–1123.
51. Macdonald AJ, Faleh O,Welch G, Kettlewell S. Missed opportunities for the detection of abdominal aortic aneurysms. Eur J Vasc Endovasc Surg 2008;35:698–700.
52. Aboyans V, Kownator S, Lafitte M, Brochet E, Emmerich J, Tribouilloy C, Lafitte S, Ferrini M. Screening abdominal aorta aneurysm during echocardiography: literatura review and proposal for a French nationwide study. Arch Cardiovasc Dis 2010;103:552–558.
53. Aboyans V, Bataille V, Bliscaux P, Ederhy S, Filliol D, Honton B, Kurtz B, Messas E, Mohty D, Brochet E, Kownator S; investigators of the E2T3A study. Effectiveness of Screening for Abdominal Aortic Aneurysm During Echocardiography. Am J Cardiol 2014; Jul 18. (published online).
54. Lederle FA, Wilson SE, Johnson GR, Reinke DB, Littooy FN, AcherCW, Ballard DJ, Messina LM, Gordon IL, Chute EP, Krupski WC, Busuttil SJ, BaroneGW, Sparks S, Graham LM, Rapp JH, Makaroun MS, Moneta GL, Cambria RA, Makhoul RG, Eton D, Ansel HJ, Freischlag JA, Bandyk D. Immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med 2002;346:1437–1444.
55. Powell JT, Brown LC, Forbes JF, Fowkes FG, Greenhalgh RM, Ruckley CV, Thompson SG. Final 12-year follow-up of surgery versus surveillance in the UK Small Aneurysm Trial. Br J Surg 2007;94:702–708.
56. Ballard DJ, Filardo G, Fowkes G, Powell JT. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev 2008:CD001835.
57. Cao P, De Rango P, Verzini F, Parlani G, Romano L, Cieri E. Comparison of surveillance versus aortic endografting for small aneurysm repair (CAESAR): results from a randomised trial. Eur J Vasc Endovasc Surg 2011;41:13–25.
58. Sweeting MJ, Thompson SG, Brown LC, Powell JT. Meta-analysis of individual patient data to examine factors affecting growth and rupture of small abdominal aortic aneurysms. Br J Surg 2012;99:655–665.
59. Sode BF, Nordestgaard BG, Gronbaek M, Dahl M. Tobacco smoking and aortic aneurysm: two population-based studies. Int J Cardiol 2013;167:2271–2277.
60. Myers J, McElrath M, Jaffe A, Smith K, Fonda H, VuA, Hill B, Dalman R.Arandomized trial of exercise training in abdominal aortic aneurysm disease. Med Sci Sports Exerc 2014;46:2–9.
61. Guessous I, Periard D, Lorenzetti D, Cornuz J, GhaliWA. The efficacy of pharmacotherapy for decreasing the expansion rate of abdominal aortic aneurysms: a systematic review and meta-analysis. PLoS One 2008;3:e1895.
62. Rughani G, Robertson L, Clarke M. Medical treatment for small abdominal aortic aneurysms. Cochrane Database Syst Rev 2012;9:CD009536.
63. Takagi H, Matsui M, Umemoto T. A meta-analysis of clinical studies of statins for prevention of abdominal aortic aneurysm expansion. J Vasc Surg 2010;52:1675–1681.
64. Hackam DG, Thiruchelvam D, Redelmeier DA. Angiotensin-converting enzyme inhibitors and aortic rupture: a population-based case-control study. Lancet 2006;368:659–665.
65. Thompson A, Cooper JA, Fabricius M, Humphries SE, Ashton HA, Hafez H. An analysis of drug modulation of abdominal aortic aneurysm growth through 25 years of surveillance. J Vasc Surg 2010;52:p55–61 e2.
66. Lindholt JS, Bjorck M, Michel JB. Anti-platelet treatment of middle-sized abdominal aortic aneurysms. Curr Vasc Pharmacol 2013;11:305–313.
67. Lindholt JS, Sorensen HT, Michel JB, Thomsen HF, Henneberg EW. Low-dose aspirin may prevent growth and later surgical repair of medium-sized abdominal aortic aneurysms. Vasc Endovascular Surg 2008;42:329–334.
68. Karlsson L, Gnarpe J, Bergqvist D, Lindback J, Parsson H. The effect of azithromycin and Chlamydophilia pneumonia infection on expansion of small abdominal aortic aneurysms: a prospective randomized double-blind trial. J Vasc Surg 2009;50:23–29.
69. Sweeting MJ, Thompson SG, Brown LC, Greenhalgh RM, Powell JT. Use of angiotensin converting enzyme inhibitors is associated with increased growth rate of abdominal aortic aneurysms. J Vasc Surg 2010;52:1–4.
70. Ferguson CD, Clancy P, Bourke B, Walker PJ, Dear A, Buckenham T, Norman P, Golledge J. Association of statin prescription with small abdominal aortic aneurysm progression. Am Heart J 2010;159:307–313.
71. Bown MJ, Sweeting MJ, Brown LC, Powell JT, Thompson SG. Surveillance intervals for small abdominal aortic aneurysms: a meta-analysis. JAMA 2013;309:806–813.
72. Devaraj S, Dodds SR. Ultrasound surveillance of ectatic abdominal aortas. Ann R Coll Surg Engl 2008;90:477–482.
73. Thompson SG, Ashton HA, Gao L, Buxton MJ, Scott RA. Final follow-up of the Multicentre Aneurysm Screening Study (MASS) randomized trial of abdominal aortic aneurysm screening. Br J Surg 2012;99:1649–156. ESC Guidelines 2926c
74. Kishi K, Ito S, Hiasa Y. Risk factors and incidence of coronary artery lesions in patients with abdominal aortic aneurysms. Intern Med 1997;36:384–388.
75. Poldermans D, Bax JJ, Boersma E, De Hert S, Eeckhout E, Fowkes G, Gorenek B, Hennerici MG, Iung B, Kelm M, Kjeldsen KP, Kristensen SD, Lopez-Sendon J, Pelosi P, Philippe F, Pierard L, Ponikowski P, Schmid JP, Sellevold OF, Sicari R, Van den Berghe G, Vermassen F. Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery. Eur Heart J 2009;30:2769–2812.
76. Boersma E, Kertai MD,Schouten O, Bax JJ, Noordzij P, SteyerbergEW, Schinkel AF, van Santen M, Simoons ML, Thomson IR, Klein J, van Urk H, Poldermans D. Perioperative cardiovascular mortality in noncardiac surgery: validation of the Lee cardiac risk index. Am J Med 2005;118:1134–1141.
77. Lee TH, Marcantonio ER, Mangione CM, Thomas EJ, Polanczyk CA, Cook EF, Sugarbaker DJ, Donaldson MC, Poss R, Ho KK, Ludwig LE, Pedan A, Goldman L. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999;100:1043–1049.
78. Kristensen OS, Knuuti J et al. Guidelines for preoperative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery. Eur Heart J 2014;doi: 10.1093/eurheartj/ehu282. Published online 1 August 2014.
79. The UK Small Aneurysm Trial Participants. Mortality results for randomised controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet 1998;352:1649–1655.
80. BrownLC, Powell JT. Risk factors for aneurysmrupture in patients kept under ultrasound surveillance. UK Small Aneurysm Trial Participants. Ann Surg 1999;230: 289–296.
81. Dubost C, Allary M, Oeconomos N. Resection of an aneurysm of the abdominal aorta: reestablishment of the continuity by a preserved human arterial graft, with result after five months. AMA Arch Surg 1952;64:405–408.
82. Blankensteijn JD, Lindenburg FP, Van der Graaf Y, Eikelboom BC. Influence of study design on reported mortality and morbidity rates after abdominal aortic aneurysm repair. Br J Surg 1998;85:1624–1630.
83. Hallin A, Bergqvist D, Holmberg L. Literature reviewof surgical management of bdominal aortic aneurysm. Eur J Vasc Endovasc Surg 2001;22:197–204.
84. Brady AR, Fowkes FG, Greenhalgh RM, Powell JT, Ruckley CV, Thompson SG. Risk factors for postoperative death following elective surgical repair of abdominal aortic aneurysm: results from the UK Small Aneurysm Trial. On behalf of the UK Small Aneurysm Trial participants. Br J Surg 2000;87:742–749.
85. Steyerberg EW, Kievit J, de Mol Van Otterloo JC, van Bockel JH, Eijkemans MJ, Habbema JD. Perioperative mortality of elective abdominal aortic aneurysm surgery. A clinical prediction rule based on literature and individual patient data. Arch Intern Med 1995;155:1998–2004.
86. Bown MJ, Sutton AJ, Bell PR, Sayers RD. A meta-analysis of 50 years of ruptured abdominal aortic aneurysm repair. Br J Surg 2002;89:714–730.
87. Dick F, Diehm N, Opfermann P, von Allmen R, Tevaearai H, Schmidli J. Endovascular suitability and outcomeafter open surgery for ruptured abdominal aortic aneurysm. Br J Surg 2012;99:940–947.
88. Franks SC, Sutton AJ, Bown MJ, Sayers RD. Systematic review and meta-analysis of 12 years of endovascular abdominal aortic aneurysm repair. Eur J Vasc Endovasc Surg 2007;33:154–171.
89. Schanzer A, Greenberg RK, Hevelone N, Robinson WP, Eslami MH, Goldberg RJ, Messina L. Predictors of abdominal aortic aneurysm sac enlargement afterendovascular repair. Circulation 2011;123:2848–2855.
90. WilsonWR,Fishwick G, Sir Peter RFB, Thompson MM.Suitability of ruptured AAA for endovascular repair. J Endovasc Ther 2004;11:635–640.
91. Kristmundsson T, Sonesson B, Dias N, Malina M, Resch T. Anatomic suitability for endovascular repair of abdominal aortic aneurysms and possible benefits of low profile delivery systems. Vascular 2013.
92. Greenhalgh RM, Brown LC, Kwong GP, Powell JT, Thompson SG. Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVARtrial 1), 30-day operative mortality results: randomised controlled trial. Lancet 2004;364:843–848.
93. EVAR trial participants. Endovascular aneurysm repair versus open repair in patients with abdominal aortic aneurysm (EVAR trial 1): randomised controlled trial. Lancet 2005;365:2179–2186.
94. Greenhalgh RM, Brown LC, Powell JT, Thompson SG, Epstein D, Sculpher MJ. Endovascular versus open repair of abdominal aortic aneurysm. N Engl J Med 2010;362:1863–1871.
95. Prinssen M, Verhoeven EL, Buth J, Cuypers PW, van Sambeek MR, Balm R, Buskens E, Grobbee DE, Blankensteijn JD. A randomized trial comparing conventional and endovascular repair of abdominal aortic aneurysms. N Engl J Med 2004; 351:1607–1618.
96. Blankensteijn JD, de Jong SE, Prinssen M, van der Ham AC, Buth J, van Sterkenburg SM, Verhagen HJ, Buskens E, Grobbee DE. Two-year outcomes after conventional or endovascular repair of abdominal aortic aneurysms. N Engl J Med 2005;352:2398–2405.
97. De Bruin JL, Baas AF, Buth J, Prinssen M, Verhoeven EL, Cuypers PW, van Sambeek MR, Balm R, Grobbee DE, Blankensteijn JD. Long-term outcome of open or endovascular repair of abdominal aortic aneurysm. N Engl J Med 2010; 362:1881–1889.
98. Lederle FA, Freischlag JA, Kyriakides TC, Padberg FT Jr., Matsumura JS, Kohler TR, Lin PH, Jean-Claude JM, Cikrit DF, Swanson KM, Peduzzi PN. Outcomes following endovascular vs open repair of abdominal aortic aneurysm: a randomized trial. JAMA 2009;302:1535–1542.
99. Lederle FA, Freischlag JA, Kyriakides TC, Matsumura JS, Padberg FT Jr., Kohler TR, Kougias P, Jean-Claude JM, Cikrit DF, Swanson KM, Group OVACS. Long-term comparison of endovascular and open repair of abdominal aortic aneurysm. N Engl J Med 2012;367:1988–1997.
100. Becquemin JP, Pillet JC, Lescalie F, Sapoval M, Goueffic Y, Lermusiaux P, Steinmetz E, Marzelle J. A randomized controlled trial of endovascular aneurysm repair versus open surgery for abdominal aortic aneurysms in low- to moderate-risk patients. J Vasc Surg 2011;53:p1167–1173 e1.
101. Soulez G, Therasse E, Monfared AA, Blair JF, Choiniere M, Elkouri S, Beaudoin N, Giroux MF, Cliche A, Lelorier J, Oliva VL. Pain and quality of life assessment after endovascular versus open repair of abdominal aortic aneurysms in patients at low risk. J Vasc Interv Radiol 2005;16:1093–1100.
102. Lottman PE, Laheij RJ, CuypersPW, Bender M, Buth J. Health-related quality of life outcomes following elective open or endovascularAAArepair: a randomized controlled trial. J Endovasc Ther 2004;11:323–329.
103. Dangas G, O’Connor D, Firwana B, Brar S, Ellozy S, Vouyouka A, Arnold M, Kosmas CE, Krishnan P, Wiley J, Suleman J, Olin J, Marin M, Faries P. Open versus endovascular stent graft repair of abdominal aortic aneurysms: a meta-analysis of randomized trials. JACC Cardiovasc Interv 2012;5:1071–1080.
104. StatherPW, Sidloff D, Dattani N, Choke E, Bown MJ, Sayers RD. Systematic review and meta-analysis of the early and late outcomes of open and endovascular repair of abdominal aortic aneurysm. Br J Surg 2013;100:863–872.
105. De Martino RR, Brooke BS, Robinson W, Schanzer A, Indes JE, Wallaert JB, Nolan BW, Cronenwett JL, Goodney PP. Designation as "unfit for open repair" is associated with poor outcomes after endovascular aortic aneurysm repair. Circ Cardiovasc Qual Outcomes 2013;6:575–581.
106. Ahmed MZ, Ling L, Ettles DF. Common and uncommon CT findings in rupture and impending rupture of abdominal aortic aneurysms. Clin Radiol 2013;68:962–971.
107. Jones CS, Reilly MK, Dalsing MC, Glover JL. Chronic contained rupture of abdominal.
108. aortic aneurysms. Arch Surg 1986;121:542–546.
109. Visser JJ, van Sambeek MR, Hamza TH, Hunink MG, Bosch JL. Ruptured abdominal aortic aneurysms: endovascular repair versus open surgery: systematic review. Radiology 2007;245:122–129.
110. Reimerink JJ, Hoornweg LL, Vahl AC, Wisselink W, van den Broek TA, Legemate DA, Reekers JA, Balm R. Endovascular repair versus open repair of ruptured abdominal aortic aneurysms: a multicenter randomized controlled trial. Ann Surg 2013;258:248–256.
111. IMPROVE Investigators. Endovascular or open repair strategy for ruptured abdominal aortic aneurysm: 30 day outcomes from IMPROVE randomised trial. BMJ 2014; 348:f7661.
112. Grootenboer N, van Sambeek MR, Arends LR, Hendriks JM, Hunink MG, Bosch JL. Systematic review and meta-analysis of sex differences in outcome after intervention for abdominal aortic aneurysm. Br J Surg 2010;97:1169–1179.
113. Mureebe L, Egorova N, McKinsey JF, Kent KC. Gender trends in the repair of ruptured abdominal aortic aneurysms and outcomes. J Vasc Surg 2010;51:9S–13S.
114. DeRango P, Lenti M, Cieri E, Simonte G,CaoP, RichardsT, Manzone A. Association between sex and perioperative mortality following endovascular repair for ruptured abdominal aortic aneurysms. J Vasc Surg 2013;57:1684–1692.
115. Prinssen M, Buskens E, Blankensteijn JD. Quality of life endovascular and open AAA repair. Results of a randomised trial. Eur J Vasc Endovasc Surg 2004;27:121–127.
116. Conrad MF, Crawford RS, Pedraza JD, Brewster DC, Lamuraglia GM, Corey M, Abbara S, Cambria RP. Long-term durability of open abdominal aortic aneurysm repair. J Vasc Surg 2007;46:669–675.
117. Hallett JW Jr., Marshall DM, Petterson TM, Gray DT, Bower TC, Cherry KJ Jr., Gloviczki P, Pairolero PC. Graft-related complications after abdominal aortic aneurysm repair: reassurance from a 36-year population-based experience. J Vasc Surg 1997;25:p277–284; discussion 285–286.
118. Wyss TR, Brown LC, Powell JT, Greenhalgh RM. Rate and predictability of graft rupture after endovascular and open abdominal aortic aneurysm repair: data from the EVAR Trials. Ann Surg 2010;252:805–812.
119. De Rango P, Verzini F, Parlani G, Cieri E, Simonte G, Farchioni L, Isernia G, Cao P. Safety of chronic anticoagulation therapy after endovascular abdominal aneurysm repair (EVAR). Eur J Vasc Endovasc Surg 2014;47:296–303.
120. Lazarides MK, Georgiadis GS, Charalampidis DG, Antoniou GA, Georgakarakos EI, Trellopoulos G. Impact of long-term warfarin treatment on EVAR durability: a meta-analysis. J Endovasc Ther 2014;21:148–153.