Capítulo 9 - Isquemia crónica de extremidades
9.1 Introducción
Podemos definir la isquemia crónica como el conjunto de signos y síntomas que se manifiestan cuando se produce una disminución progresiva del flujo sanguíneo en una extremidad por una obstrucción total o parcial de una o mas arterias, de forma tal que pueden resentirse tanto su función como su supervivencia.
9.2 Epidemiología
Las enfermedades cardiovasculares representan el 48% de todas las causas de muerte y, por tanto, tienen un importante impacto de sufrimiento personal y coste sanitario, laboral y económico.
La cardiopatía isquémica, la hipertensión y la enfermedad cerebrovascular son las principales causas de muerte entre las enfermedades cardiovasculares y se encuentran además entre las principales causas de incapacidad laboral. La enfermedad arterial periférica es menos frecuente que la enfermedad cardíaca pero más que el infarto cerebral.
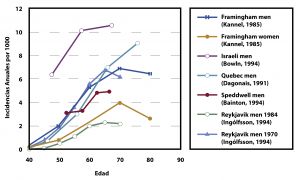
Diversos estudios epidemiológicos han establecido que la prevalencia (número de personas que están afectadas por una enfermedad en un periodo determinado de tiempo) de la enfermedad arterial periférica (EAP) enmiembros inferiores es <5% antes de los 50 años de edad, alrededor del 10% a los 65 años y del 25% en personas de 80 o más años. Sin embargo, la claudicación intermitente solo se presenta en el 0,4 por 1000 de los varones entre 35 y 45 años y el 6 por mil de los mayores de 65 años.
La incidencia en mujeres es de un 40-60% menor pero tiende a igualarse entre los 65 y 74 años. En general, las diferencias sexuales de incidencia y prevalencia no son tan claras como en otras enfermedades cardiovasculares.
Gráfica 1
Dado que la EAP y otras enfermedades cardiovasculares y cerebrovasculares comparten la misma etiología y factores de riesgo se ha estudiado epidemiológicamente el riesgo de padecer cualquiera de estas patologías. Para un enfermo con EAP el riesgo de IM (infarto de miocardio) 2,5 veces mayor que el que no tiene EAP, para angor la prevalencia es de 1,9 veces mayor, para ICC (insuficiencia cardiaca congestiva) 3,3 veces mayor, para ictus 3,1 veces mayor y para AIT (accidente isquémico transitorio) es 2,3 veces mayor. Inversamente, el riesgo de presentar EAP en pacientes con estas patología estárespectivamente aumentado en 2,1 en IM, 1,7 en angina, 2,6 en ICC, 2,4 en ictus y 2,1 en AIT.
Los pacientes con EAP tienen una alta correlación con estenosis carotídea y una correlación moderada en la gravedad de los síntomas de ambas enfermedades.
9.3 Etiología
La aterosclerosis es la principal causa de isquemia en miembros inferiores en la inmensa mayoría de los pacientes que la padecen (95%). Aunque más frecuente en Oriente, la tromboangeitis obliterante (enfermedad de Buerger) también es causa de isquemia. Otro tipos de vasculitis, como la enfermedad de Takayasu y de Horton (arteritis de la temporal), pueden presentarse con claudicación en miembros inferiores.
Causas aún mas raras son el atrapamiento poplíteo, la degeneración quística de la media, la displasia fibromuscular o las arteritis específicas (salmonela, lúes).
9.4 Factores de Riesgo
La aterosclerosis, responsable del 95% de los casos de isquemia crónica en miembros inferiores, tiene una etiología multifactorial que no estádefinitivamente aclarada. Sin embargo es agravada por una serie de factores de riego.
9.4.1 Factores genéticos
Parece que la tendencia a desarrollar aterosclerosis en algunos grupos familiares puede ser debida a factores genéticos hereditarios que influyen en los factores de riesgo (hiperlipemia, HTA, diabetes, síndrome de Werner, etc). Los factores genéticos parecen jugar un papel importante pero los datos son aún escasos.
9.4.2 Diabetes
Afecta a un 5 % de la población total y es un factor de riesgo mayor en el desarrollo de aterosclerosis hasta el punto de que un 75% de estos enfermos mueren por complicaciones vasculares.
La enfermedad arterial en miembros inferiores es 20 veces mas frecuente en diabéticos, y estápresente, por término medio en el 13% de todos ellos. En el momento del diagnóstico el 8% de los pacientes diabéticos tiene evidencia clínica de isquemia en miembros inferiores, 10 años después del diagnóstico el porcentaje se incrementa hasta el 15% y a los 20 años de seguimiento llega al 45%. La diabetes es responsable del 50-70% de todas las amputaciones no traumáticas.
La diabetes tiene un gran impacto en el desarrollo de enfermedad vascular en la mujer, que tiene la misma incidencia de enfermedad coronaria, cerebro-vascular o vascular periférica que el hombre.
El adecuado control de los niveles de glucemia en diabéticos no parece retrasar el desarrollo de la enfermedad vascular, pero tampoco existe correlación directa entre severidad de la diabetes y severidad de la enfermedad vascular en grandes vasos. La enfermedad vascular en grandes vasos se detecta con mayor frecuencia en la diabetes tipo II, en parte porque ésta se presenta en edades mas tardías. En cambio, si corregimos el factor edad la incidencia en el tipo I es un 6-12% mayor.
En los diabéticos se afecta menos el sector aortoilíaco y más las arterias femoral profunda y tibiales (sector aortoilíaco 6,4%, sector femoropoplíteo 26,3% y sector tibial 63,6%). Cuando existe afectación aortoilíaca hay mayor frecuencia de enfermedad coronaria y cerebro-vascular asociada.
Se ha comprobado que en pacientes diabéticos los resultados terapéuticos son peores: tienen 5 veces mas posibilidades de amputación y 3 veces mas mortalidad que la EAP en no diabéticos.
9.4.3 Tabaco
El tabaco supone un factor de riesgo muy alto para desarrollar enfermedad arterial periférica. El 31% de los varones adultos y el 20,7 % de las mujeres fuman y los fumadores de 20 o más cigarrillos diarios tiene entre 2 y 3,4 veces mas posibilidades de presentar claudicación intermitente que los no fumadores.
El 90% de los pacientes con enfermedad aortoilíaca y el 91% de los que tienen afectación femoropoplítea son fumadores. En pacientes operados se ha detectado empeoramiento clínico o menor porcentaje de permeabilidad de los by-pass si continúan fumando. El incremento de riesgo vascular es dosis dependiente y en trabajadores no fumadores que desarrollan su actividad entre fumadores se han detectado niveles de nicotina equivalentes a fumar 5 cigarrillos diarios. De las aproximadamente 4.000 sustancias detectadas en la combustión del cigarro solo la nicotina (aumenta gasto cardíaco, aumento de la fracción de eyección, aumento de la presión sistólica, estimula la liberación de catecolaminas que provocan vasoconstricción cutánea, reduce el flujo cerebral e incrementa la agregación plaquetaria con riesgo de trombosis espontáneas) y el monóxido de carbono (reduce la capacidad de transporte de O2 por la hemoglobina, parada cardíaca en enfermos coronarios por aumento de la demanda de oxígeno miocárdico y disminución de la liberación por la hemoglobina, hipoxia celular y aumento de la permeabilidad a lipoproteinas en células endoteliales) han sido estudiados en profundidad en su relación con la enfermedad vascular periférica.
9.4.4 Hipertensión
Es un factor de riesgo significativo en el desarrollo de aterosclerosis y enfermedad vascular. Es el principal factor de riesgo de infarto cerebral secundario a enfermedad de la bifurcación carotídea. La relación entre HTA y enfermedad vascular periférica manifestada por claudicación intermitente es débil. El estudio Framingham muestra mayor tendencia a padecer isquemia crónica de miembros inferiores con mayores niveles de TA. La correlación es mayor si valoramos solo la TA sistólica y no la diastólica. Son mucho mas importantes la diabetes y el tabaco que la HTA en el desarrollo de enfermedad vascular periférica.
9.4.5 Hiperlipemia
La hipercolesterolemia es el mayor factor para el desarrollo de enfermedad vascular oclusiva. La correlación es muy fuerte, dosis-dependiente y presente en ambos sexos.
El colesterol HDL es protector frente a la EAP. Se considera el la proporción entre colesterol total (CT) y HDL (CHDL) la mejor medida lipídica de riego (índice CT/CHDL).
El estudio de los triglicéridos da resultados mas controvertidos ya los datos sugieren que de forma monofactorial (aisladamente ) no influye en el desarrollo de la EAP pero sícuando se asocia a otros factores de riesgo cardiovascular ( multifactorial ).
9.4.6 Ejercicio
Tiene un papel poco definido en el desarrollo de la aterosclerosis y sus manifestaciones clínicas. Existe mayor riesgo de mortalidad cardiovascular y enfermedad coronaria en los varones sedentarios y no afecta a la mujer. Sin embargo, no existe ninguna relación entre actividad física y desarrollo de claudicación intermitente.
9.4.7 Obesidad
Aunque de forma controvertida se acepta que la obesidad es un factor que contribuye al desarrollo de aterosclerosis pero, aunque existe un mayor porcentaje de enfermedad coronaria e infarto cerebral, no existe correlación significativa entre exceso de peso y claudicación intermitente.
9.4.8 Raza
Aunque los estudios no son concluyentes parece existir mayor predisposición a padecer EAP en la raza negra, y con distribución anatómica de las lesiones mayor en vasos tibiales. Los asiáticos, sin embargo, presentan una prevalencia menor.
9.4.9 Homocisteína
Aunque estudios iniciales parecían demostrar que niveles altos de homocisteína en sangre se asociaban a un mayor riesgo de padecer EAP hoy en día, a raíz de posteriores estudios, no puede confirmarse esta relación.
9.4.10 Proteína C reactiva y fibrinógeno
Son dos marcadores inflamatorios asociados a la EAP en diversos estudios
9.4.11 Factores psicológicos
No se ha establecido correlación alguna entre los diferentes tipos de personalidad y el desarrollo de enfermedad arterial periférica, aunque algunos estudios han establecido una relación entre ansiedad, estrés laboral y la forma de afrontar conflictos laborales con la claudicación intermitente.
Para la EAP los factores de riesgo principales fueron tabaquismo y edad, mientras que la diabetes era más importante en las formas graves de EAP.
Los estudios epidemiológicos también demuestran que existe mayor correlación entre tabaco y EAP que con enfermedad coronaria.
La evolución desfavorable de la enfermedad se correlaciona con la presentación precoz (< 45 años) y la progresión en grandes vasos con el índice CT/CHDL, la lipoproteína (a) y la PCR de alta sensibilidad ( Proteína C reactiva ), mientras que la progresión en pequeños vasos se relaciona solo con la diabetes.
9.5 Fisiopatología
En condiciones normales el flujo sanguíneo arterial en un vaso de conducción regional estácondicionado por la presión y la resistencia del lecho vascular ( Flujo arterial =Presión + Resistencia vascular ). Las arterias normales tienen una gran capacidad para soportar aumentos importantes del flujo sin que se produzca una reducción de la presión a lo largo del vaso, esto implica que durante el ejercicio pueda aumentar el flujo arterial hacia los músculos a expensas de una vasodilatación que disminuye la resistencia vascular periférica.
La función de este flujo arterial es posibilitar el consumo celular de oxígeno tanto en reposo como durante el ejercicio. La cantidad del oxígeno va a depender de suministro (captación pulmonar, capacidad de unión a la hemoglobina y flujo regional), y de la extracción del mismo a nivel mitocondrial de la célula del músculo esquelético. En personas sanas el consumo máximo de oxígeno viene determinado por el suministro, no por la función mitocondrial. La capacidad oxidativa mitocondrial estávinculada a la capacidad máxima de ejercicio y puede aumentar con el entrenamiento.
Cuando una arteria comienza a presentar lesiones estenosantes este equilibrio se altera ya que la resistencia arterial va a aumentar, modificando la presión del flujo sanguíneo. Recordemos que la ecuación de Poiseuille establece las relaciones entre flujo, presión y resistencia:
Reducción de flujo=Flujo sanguíneo (8Lŋ) +∏r2
L es la longitud de la estenosis. ŋ es la viscosidad, r es el radio interno de la estenosis.
En esta ecuación el factor principal que condiciona la presión de flujo es el radio de la estenosis de forma que una reducción del 50% de la luz del vaso multiplica la resistencia por 16. La longitud de la estenosis es inicialmente menos relevante que el grado de estenosis pero su importancia aumenta a medida que se presentan múltiples lesiones en línea a lo largo de los vasos. Esta disminución del flujo arterial hacia los músculos seráel desencadenante de la sintomatología isquémica.
Se considera estenosis arterial crítica cuando existe una disminución del flujo distal a la estenosis (lo que tiene importancia en la aparición de síntomas). Este criterio varía enormemente entre el reposo y el ejercicio, asíen reposo una estenosis crítica debe tener un 90%, mientras que durante el ejercicio una estenosis del 50% ya produce disminución de flujo distal y posibilidad de síntomas con el ejercicio (claudicación).
Cuando un paciente con EAP estáen reposo raramente tiene sintomatología (solo en casos severos ya que el flujo sanguíneo es suficiente para mantener unas funciones metabólicas relativamente bajas). Al iniciar el ejercicio hay un aumento del flujo sanguíneo y del consumo celular de oxígeno, sin embargo al aumentar el ejercicio el flujo sanguíneo alcanza una meseta (producida por las estenosis) en la que no es capaz de compensar las necesidades metabólicas y de oxígeno de los tejidos, a pesar también del aumento de la extracción mitocondrial de oxígeno, y aparece el dolor y la claudicación.
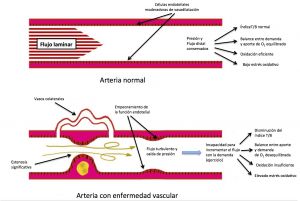
El flujo sanguíneo y su distribución en el lecho muscular esquelético dependen de la actividad endotelial y de los factores microcirculatorios. El ON (óxido nítrico) endotelial es esencial en la regulación del tono vascular y las prostaglandinas son importantes mediadores autocrinos y paracrinos de la resistencia vascular durante el ejercicio. Sin embargo los pacientes ateroscleróticos presentan unaanomalía sistémica de la función endotelial asociada a una alteración de la vasodilatación y un aumento de la agregación plaquetaria. Esto implica que en los enfermos con EAP el aporte de oxígeno no solo depende del grado de estenosis sino también de la disfunción endotelial y la capacidad vasodilatadora.
También existe una alteración de las propiedades hemorreológicas de la sangre con un aumento de la viscosidad. Los pacientes con EAP tienen niveles altos de concentración plasmática de fibrinógeno, del factor von Willebrand, del inhibidor del activador plasminógeno y aumento del recambio de fibrina. Estos cambios tienen una correlación directa con la disminución del la actividad física y se manifiestan a nivel de la microcirculación con aumento de la viscosidad y pérdida de flexibilidad de la pared de los eritrocitos, que se traduce en la aparición de microtrombos.
Fig. 1 Esquema fisiopatología isquemia crónica
En la isquemia crítica se ha podido comprobar que también existe un componente celular alterado que aumenta la viscosidad de la sangre y puede desencadenar microtrombosis capilar a partir de la elevación del número de leucocitos y activación de la adhesividad leucocitaria (posiblemente en relación con la expresión endotelial de moléculas de adhesión vascular como la VCAM-1 y la selectiva E) con otros neutrófilos y células sanguíneas. También el número de plaquetas estáaumentado y activado, de manera que la liberación de tromboxano produce una potente vasoconstricción local.
En resumen, en la EAP se produce una disminución de la capacidad vasodilatadora (disminución de ON y PG) y aumento de la vasoconstricción (tromboxano) que junto a los cambios hemorreológicos (aumento de la viscosidad de la sangre) favorecen un incremento de la isquemia titular. En conjunto la isquemia durante el ejercicio y la repercusión durante la recuperación se asocian a un aumento del estrés oxidativo.
Las medidas que disminuyan o regulen este estrés oxidativo pueden ser importantes para prevenir tanto el avance de la enfermedad aterosclerótica como para proteger al músculo esquelético.
9.6 Clínica
La sospecha clínica de isquemia crónica en miembros inferiores es alta en ancianos, personas con antecedentes de enfermedad aterosclerótica coronaria o cerebral y en aquellos que tienen factores de riesgo cardiovascular como diabetes, tabaquismo o insuficiencia renal. Por debajo de los 40 años de edad es rara la enfermedad y una anamnesis cuidadosa nos permitiráestablecer la sospecha inicial. Sin embargo no hay que olvidar que muchos pacientes con EAP son asintomáticos (89%) por lo que la exploración física y pruebas diagnósticas son necesarias.
Cuando la EAP es sintomática generalmente se presenta con claudicación intermitente que no es mas que la aparición de un dolor muscular isquémico durante el ejercicio. Los pacientes lo manifiestan de diversas formas (dolor, malestar quemazón, pesadez, tensión, opresión o calmbres) pero siempre se origina en un compartimento muscular, nunca en una articulación. La reducción o cese del ejercicio hace que el dolor cese rápidamente.
Se habla de distancia de claudicación inicial a la distancia recorrida hasta el inicio de la aparición de claudicación y de distancia de claudicación absoluta a la distancia máxima que el paciente puede recorrer antes de tener que detenerse.
Otras formas de presentación son dolor en reposo, lesiones cutáneas o necrosis en extremidades.
La presencia de claudicación tiene valor pronóstico: el 75% de los pacientes tendrán síntomas estables los próximos 10 años, un 25% empeoraráy precisarárevascularización o amputación y además, su mortalidad seráel doble que la de la población general.
En 1920 se establecióla clasificación de La Fontaine que divide a la isquemia crónica de los miembros inferiores en cuatro grados clínicos. Su carácter práctico hace que se siga utilizando en la actualidad en Europa.
• Grado I: Asintomático, ya sea porque la obstrucción del vaso no es completa o porque se han desarrollado mecanismos de compensación a expensas de arterias colaterales.
• Grado II: Se caracteriza por la presentación de claudicación intermitente. Al fracasar los mecanismos de compensación el paciente presenta dolor muscular con la deambulación por hipoxia tisular. La gran mayoría de las veces se localiza a nivel de masas gemelares y el dolor obliga al paciente a detenerse tras recorrer algunos metros; con el reposo desaparece el dolor. A efectos prácticos dividimos este grupo en dos subgrupos:
o II-A: el paciente claudica a mas de 150 m.
o II-B: el paciente claudica a una distancia igual o menor a 150 m.
• Grado III: Se caracteriza porque el paciente presenta dolor en reposo. Se suele localizar en dedos y pies, es continuo, progresivamente intolerable, empeora con la elevación de la extremidad y mejora con el declive de la misma. Se acompaña de alteraciones de la sensibilidad y la piel aparece fría y pálida, aunque a veces, con el pie en declive, éste puede verse eritematoso (pie de langosta).
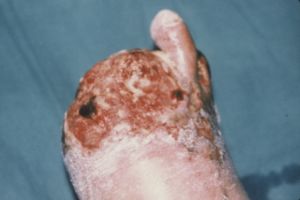
• Grado IV: Se caracteriza por la aparición de úlceras y necrosis en la extremidad con independencia de la capacidad del paciente para caminar. Pueden ser lesiones más o menos extensas y aparecen entre el 1% y el 3% de todos los pacientes que desarrollan síntomas.
Otra clasificación utilizada con frecuencia es la de Rutherford:
• Grado 0: Paciente asintomático
• Grado 1: Claudicación mínima
• Grado 2: Claudicación moderada
• Grado 3: Claudicación máxima
• Grado 4: Dolor isquémico de reposo
• Grado 5: Pérdida tisular menor
• Grado 6: Pérdida tisular mayor
Además de esta clasificación clínica, habitualmente utilizada en la literatura anglosajona, nos encontraremos un término: isquemia crítica, que tiene especial relevancia para definir la situación de alto riesgo ( 300-1000 personas/millón/año y del 1,2% en la población entre 60 y 69 años con ligero predominio femenino ). Se define como " una isquemia en la que potencialmente puede perderse una extremidad o parte de ella " y debe cumplir dos criterios: dolor de reposo persistente que requiere analgesia de forma habitual durante mas de dos semanas y/o úlceras o gangrena en el pie o los dedos, además de presión sistólica en tobillo inferior a 50 mm Hg. Este criterio de isquemia crítica equivaldría a los grados III y IV de la clasificación de la Fontaine y 4, 5 y 6 de la clasificación de Rutherford.
9.6.1 Formas de presentación clínica
Dependiendo de la topografía de las lesiones estenosantes u obstructivas podemos distinguir 3 formas clínicas:
•Obstrucción aortoilíaca (enfermedad aortoilíaca 24% e iliofemoral 4%).
•Obstrucción femoropoplítea (enfermedad femoropoplítea 50% y poplítea 5%).
•Obstrucción tibioperonéa (17 %).
9.6.1.1 Obstrucción aortoilíaca
La ateromatosis aortoilíaca comienza a desarrollarse en una de las arterias ilíacas primitivas y va estenosando progresivamente la luz hasta ocluirla. Paralelamente se va desarrollando la enfermedad en el vaso contralateral, pudiendo desembocar en una obstrucción de la aorta terminal. Esta forma de presentación, conocida como síndrome de Leriche, consta de una triada clínica: claudicación intermitente bilateral, impotencia/amenorrea y ausencia de pulsos femorales.
Esta forma clínica es de presentación precoz, entre los 35 y 55 años, afecta a los varones en una relación 3:1 con las mujeres, la claudicación es alta, en glúteos o muslos, en un 50% de los casos.
A la exploración destaca ausencia de todos los pulsos en las extremidades asociado a palidez, frialdad y parestesias en piernas, atrofia muscular y cicatrización tórpida de heridas en las extremidades.
El 50% de estos pacientes son hipertensos y el 75% padecen cardiopatía isquémica. Metabólicamente existe importante correlación con la hiperlipemia y escasa con la diabetes. Hay alta incidencia de tabaquismo.
El diagnóstico diferencial debe realizarse con: lumbociática, hernias discales, lesiones del plexo crural, sacroileítis y coxartrosis, la trombosis venos ilíaca y con la endofibrosis de la arteria iliaca externa que es una raro trastorno en ciclistas que entrenan mucho. Las displasías fibromusculares son más frecuentes en arterias renales y carótidas pero pueden presentarse también en miembros inferiores, especialmente en arterias iliacas.
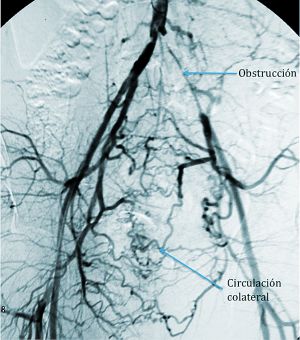
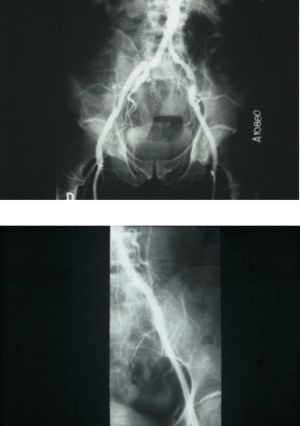
Fig. 2 Arteriografia aortoilíaca
9.6.1.2 Obstrucción femoropoplítea
La causa mas frecuente de isquemia crónica es la obstrucción de la arteria femoral superficial, constituyendo el 50% de todos los casos. El origen parece estar en un problema de tipo mecánico, ya que la fascia de los aductores tracciona oblicuamente de la femoral superficial en la parte superior del canal de Hunter provocando un microtrauma continuado que desembocaría en la estenosis y posterior obstrucción de la arteria.
Clínicamente se caracteriza por una edad de comienzo que oscila entre los 50 y 70 años, la claudicación es gemelar, unilateral inicialmente y progresando a bilateral en un 50% de los casos, y se asocia a parestesias en el tarso. A la exploración se palpan los pulsos femorales pero están ausentes los poplíteos y distales y son frecuentes las lesiones tróficas y las necrosis.
Son pacientes con una alta incidencia de tabaquismo, HTA, diabetes del adulto, cardiopatía isquémica y lesiones de troncos supraaórticos.
Las oclusiones aisladas de arteria poplítea generalmente se deben a trombosis de un aneurisma poplíteo, o patologías vasculares no ateroscleróticas como el atrapamiento poplíteo (generalmente por un origen anómalo del músculo gastrocnemio interno) que puede presentarse en personas jóvenes y deportistas o la degeneración quística de la media.
El diagnóstico diferencial se realiza con las trombosis venosas profundas y flebitis superficiales, dolores musculares difusos (eritromelalgia, síndrome de las piernas inquietas,...), neuropatías periféricas, síndrome del compartimento tibial anterior, miopatías (distrofia de Duchenne, de Becker, distrofia miotónica de Crushmann-Steinert,...), alteraciones de la placa motora (miastenia gravis, síndrome de Eaton-Lambert, etc.), alteraciones metabólicas y enzimáticas diversas (hiperparatiroidismo, hiper e hipotiroidismo, enfermedad de Cushing y Adisson, acromegalia,...), colagenosis (polimiositis, LES, síndrome de Sjögren, periarteritis nodosa, etc...), intoxicaciones (etilismo crónico, ingesta crónica de corticoides, cloroquina, penicililamina,…). Especial mención merece el síndrome compartimental de esfuerzo porque el tamaño de los músculos de la pantorrilla durante el ejercicio pueden dificultar el retorno venoso (aumenta la presión tisular y disminuye el flujo microvascular) y causar dolor u opresión en la pantorrilla con el esfuerzo.
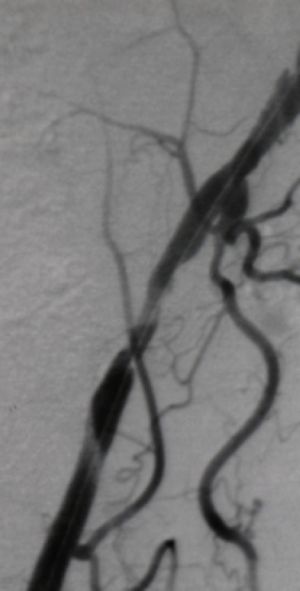
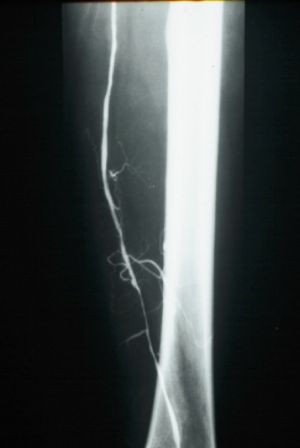
Fig. 3 Arteriografía: Detalle estenosis femoral
9.6.1.3 Obstrucción tibioperonéa
La afectación ateromatosa de arterias tibiales es la menos frecuente de todas las causas de isquemia crónica. Es más frecuente en paciente con diabetes y tromboangeitis obliterante.
Clínicamente se caracteriza por claudicación plantar o en antepie. A la exploración se encuentra ausencia de pulsos pedios y tibiales posteriores, hiperestesia al tacto en el pie, atrofia músculo-cutánea y úlceras isquémicas en dedos.
9.7 Diagnóstico
9.7.1 Historia clínica
En muchos casos es suficiente un interrogatorio sobre los síntomas, forma de aparición, localización, progresión, etc., para establecer una sospecha diagnóstica.
9.7.2 Exploración física
Debe realizarse una exploración general del paciente y especialmente de todo el sistema circulatorio.
La inspección de las extremidades (pérdida de vello en piernas, sequedad, pérdida de brillo, onicomicosis, ulceraciones, necrosis, trayectos de linfangitis, edema, eritema, palidez o cianosis y atrofia muscular son diversas alteraciones que pueden encontrarse en la isquemia), la palpación de la temperatura en los pies o de los pulsos a lo largo de ambas extremidades nos informa sobre el lugar donde se puede encontrar la obstrucción arterial y finalmente la auscultación de soplos, especialmente a nivel femoral, orienta sobre la posibilidad de estenosis al flujo arterial por encima o en el lugar de la auscultación.
Fig. 4 Palpación pulso pedio
Fig. 5 Palpación pulso tibial posterior
Con la historia y la exploración física podemos establecer en un gran número de casos un diagnóstico de certeza tanto del grado clínico como de la topografía. Sin embargo, son imprescindibles otros tipos de pruebas que nos permitan confirmar la sospecha clínica, cuantificar el grado de deterioro de la circulación arterial, la localización de estas lesiones, la evolución clínica y la respuesta a los tratamientos médicos o quirúrgicos. Estos tipos de pruebas son: los estudios vasculares no invasivos y las pruebas de imagen.
9.7.3 Estudios vasculares no invasivos
Su objetivo es confirmar la existencia de lesiones, su localización, repercusión hemodinámica, valoración de otras lesiones más proximales asícomo el estado del lecho arterial distal. Disponemos de diversas técnicas:
- Ergometría. Se realiza en una cinta sin fin en la que se programa previamente una velocidad (3-4 km/hora ) y una pendiente predeterminadas (0-12%). Primero se determina un índice tobillo/brazo basal y después los pacientes deben caminar hasta que el dolor les obliga a pararse estimándose la distancia de claudicación inicial y la distancia de claudicación absoluta. Al finalizar se realiza un nuevo índice tobillo/brazo de forma que podremos conocer el grado de claudicación de forma objetiva y su evolución en el tiempo, al mismo tiempo que la variación del índice tobillo/brazo inicial y final estádirectamente relacionado con la gravedad de la enfermedad.
–Doppler continuo y pulsado, que nos aportarán información sobre la presencia o ausencia de flujo y características hemodinámicas del mismo (laminar, turbulento, velocidad de flujo, resistencias distales,...) en cada uno de los vasos de las extremidades.
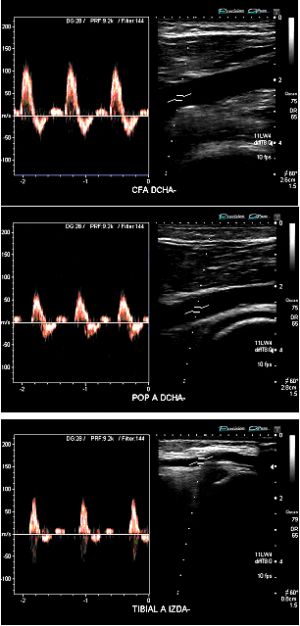
–Eco-Doppler, donde la combinación de la ecografía (modo B), ecografía Doppler color y el análisis de la velocidad de la sangre mediante Doppler pulsado
puede identificar con precisión la ubicación y grado de estenosis de las lesiones ateroscleróticas. La sensibilidad y especificidad para detectar estenosis del 50% es del 88 y 96% respectivamente y para detectar oclusión completa del 90 y 99%. Es menos precisa en zonas de pared calcificada por la sombra acústica producida por el calcio.
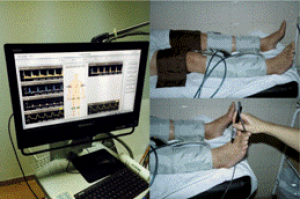
Fig. 6 Equipo Eco-doppler
Fig. 7 Registro flujo e imagen en eco-doppler
–Presiones segmentarias, que nos permiten determinar la presión de la sangre en cada sector de la extremidad (muslo, pierna y tobillo) correlacionándolas entre sícon la extremidad contralateral y con la presión en antebrazo (considerada como normal).
Fig. 8 Registro presiones segmentarias
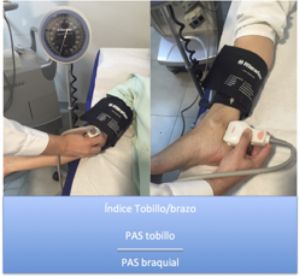
Una alternativa de gran utilidad clínica es el índice tobillo/brazo. Consiste en tomar la presión sistólica en el brazo, posteriormente tomar la tensión sistólica medida con doppler en uno de los vasos del tobillo y establecer un cociente donde :
Fig. 9 Índice tobillo/brazo
Se considera que existe enfermedad arterial periférica si el resultado es <0,9.
–Otros métodos de menor valor diagnóstico son la pletismografía, la presión parcial de oxígeno (PO2 transcutánea) y la capilaroscopia.
Las exploraciones vasculares no invasivas se caracterizan por ser:
Simples
Rápidas
Fáciles de reproducir
Registrables
Estandarizadas
Realizables tanto en reposo como post-esfuerzo
No precisanpersonal médico en muchos casos
9.7.4 Exploraciones invasivas
Fundamentalmente la arteriografía en sus diversas modalidades. Es la mejor prueba en el diagnóstico final para conocer la extensión, topografía de las lesiones y desarrollo de vasos colaterales en la oclusión arterial. Es útil para realizar diagnósticos diferenciales con otros procesos que cursan con isquemia aguda, especialmente con los embolismos arteriales y sobre todo para planificar.
Fig. 10 Arteriografía
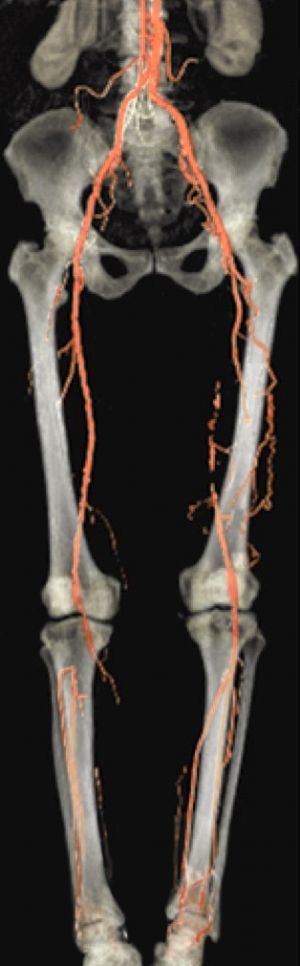
la estrategia quirúrgica. Se considera el patrón de referencia para el resto de pruebas. Sin embargo, su carácter invasivo, la necesidad de contraste que puede ser nefrotóxico, el riesgo de ateroembolias, seudoaneurismas y fístulas A-V hacen que esté siendo sustituida, en muchos casos, por otras pruebas menos agresivas y que en ciertos casos pueden aportar información adicional como el AngioTAC y la AngioRNM.
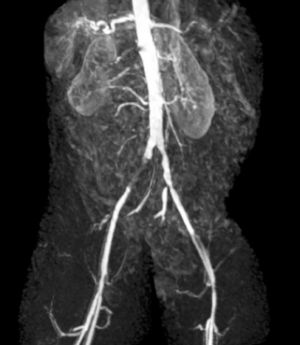
Fig. 11 AngioRNM
Fig.12 AngiotTAC
9.8 Diagnóstico Diferencial
Como hemos visto en el apartado anterior hay que tener en cuentas varias patologías vasculares y no vasculares.
Los trastornos vasculares son: compresión de la arteria poplítea, síndrome compartimental, endofibrosis de la arteria iliaca externa, displasia fibromuscular, insuficiencia venosa y vasculitis.
Entre las patologías no vasculares: radiculopatía lumbar, artrosis de cadera, rodilla y la miositis.
Por otra parte, la isquemia crítica debe diferenciarse de otras patologías:
La ateroembolia o síndrome del dedo azul ocurre cuando se producen microembolizaciones en las arterias digitales de fragmentos de placas de ateroma desde los grandes vasos. Es frecuente su aparición tras manipulación de estos vasos (cateterismos o cirugías). En estos pacientes los pulsos suelen palparse, es frecuente la aparición reciente de insuficiencia renal y se detecta eosinofilia.
La isquemia aguda por embolia o trombosis arterial aguda.
Otras causas son cuadros isquémicos por vasoespasmo, vasculitis o enfermedades del colágeno.
Como causa de úlceras dolorosas hay que tener en cuenta las neuropáticas, las artritis ( gota ), las fascitis y los traumatismos.
9.9 Tratamiento
El tratamiento no debe enfocarse de forma aislada sino en el contexto de una enfermedad sistémica (IAM, ictus, aneurismas…) en la que la sintomatología en los miembros inferiores puede ser solo una manifestación más y que comparten unos factores de riesgo comunes que deben ser controlados.
Como en toda enfermedad, el tratamiento estádirigido a:
-Conseguir la remisión de la sintomatología.
-Mantener la mejoría obtenida.
-Evitar la progresión de la enfermedad.
-Prevenir la recurrencia.
-Mantener la calidad de vida del paciente y la funcionalidad de la extremidad.
Para ello disponemos de tres opciones: hábitos de vida/tratamiento farmacológico, endovascular y quirúrgico.
9.9.1 Tratamiento de los hábitos de vida/tratamiento farmacológico
9.9.1.1 Control de factores de riesgo
Evitar la progresión de la enfermedad, controlando los factores etiopatogénicos de riesgo:
• Abstención de tabaco (los fumadores tiene 3 veces más riesgo de EAP que los no fumadores). Los pacientes con EAP que siguen fumandotienen un porcentaje elevado de evolución a isquemia crítica en los 7 años siguientes al diagnóstico, aumento de la necesidad de revascularización quirúrgica, aumento de la tasa de infarto de miocardio y una disminución de la esperanza de vida, asícomo peores resultados tras la revascularización. También influye el grado de tabaquismo, asílos fumadores de >15 cigarrillos diarios tienen una tasa de supervivencia significativamente menor que los que fuman < 15 cigarrillos diarios y una tasa de amputación 10 veces superior. Conseguir la abstinencia tabáquica es un objetivo difícil que precisa de apoyo psicológico y en muchas ocasiones apoyo farmacológico (Bupropión, Vareniclina,…). Conseguir el abandono del tabaco es un objetivo prioritario del tratamiento.
Fig. 13 Tabaquismo
• Combatir la obesidad y el sedentarismo con una actividad acorde a la edad y estado general del paciente.
• Controlar la dislipemia. El colesterol total elevado y la LDL altas son factores de riesgo en la EAP que deben ser controlados. Se ha demostrado que el tratamiento hipolipemiente con los inhibidores de la HMG-CoA reductasa (estatinas) ha demostrado mejoría en la claudicación y disminución de eventos cardiovasculares secundarios. El objetivo es conseguir mantener niveles LDL < 100 mg/dl y es casos de alto riesgo isquémico niveles < 70 mg/dl.
• Controlar la diabetes. Varios estudios han demostrado la relación entre diabetes y EAP (2 a 4 veces mayor que en no diabéticos). El objetivo es conseguir que estos pacientes reciban un tratamiento hipoglucemiante que estabilice la HB A1c < 7%.
• Controlar la HTA. Aunque el control de la HTA ha demostrado ser beneficioso para prevenir ACVA, IM e insuficiencia cardiaca congestiva (ICC) hay pocos estudios que hayan demostrado de forma específica el beneficio en pacientes con EAP. Diversos estudios han demostrado que el uso de betabloqueantes, IECA o ARA son seguros en la EAP y no la empeoran. En cualquier caso el adecuado control de la HTA en pacientes con EAP disminuye las complicaciones cardiovasculares sintéticas, especialmente en pacientes diabéticos.
9.9.1.2 Ejercicio físico. Cuidados personales.
Forma parte básica y fundamental del tratamiento, con el que conseguiremos:
Aumento de la red colateral.
Cambios en las fibras musculares, con Aumento de mitocondrias.
Activación de la fibrinolisis.
Disminución de la viscosidad sanguínea.
Contribuir al control de la dislipemia y la diabetes.
Contribuir a controlar la obesidad y el stress.
Mejora el estado general.
Varios metaanálisis realizados demuestran que el ejercicio supervisado mejora hasta en un 150% la distancia máxima de claudicación. Esta mejoría se atribuye al desarrollo de circulación colateral y a la vasodilatación mediada por ON secretado a nivel endotelial que a su vez tiene efectos hemorreológicos y angiogénicos.
Los programas supervisados aconsejan emplear una cinta sin fin y realizar ejercicios entre 45 y 60 minutos, tres veces a la semana durante al menos 12 semanas.
Es conveniente dedicar mucha atención al cuidado de los pies para prevenir úlceras o infecciones, especialmente en pacientes que son diabéticos y con isquemia crítica. Es importante la hidratación de la piel, calzado blando y adaptable, calcetines de fibra natural absorbente. La inspección minuciosa diaria del pie para detectar alteraciones cutáneas debe ser habitual.
En pacientes con dolor de reposo la extremidad debe colocarse en declive para mejorar la perfusión y en caso de edema mantenerla horizontal. Conviene usar en estos pacientes algodón para acolchar todas las posibles zonas de decúbito del píe y entre los dedos. Evitar aplicar calor en los pies isquémicos.
9.9.1.3 Medicación Antiagregante
Dado el importante papel desempeñado por las plaquetas en la formación del trombo, es lógico pensar que los fármacos que interfieran en la agregación plaquetaria sean útiles en el control y tratamiento de la isquemia crónica. La ventaja es que son fármacos que no precisan de controles analíticos estrictos (como en el caso de los anticoagulantes), lo que es especialmente importante en los tratamientos ambulantes a largo plazo. Los principales son: ácido acetilsalicílico, dipiridamol, trifusal, ticlopidina, y clopidogrel, prostaglandinas, eicosanoides (ácidos grasos omega-3).
En vista de que los estudios epidemiológicos muestran una reducción del 25% de episodios vasculares graves se recomienda que todos los pacientes con EAP reciban tratamiento antiagregante (recomendación Clase I), especialmente en los pacientes sintomáticos. Como primera línea se recomienda ácido acetilsalicílico (dosis entre 81-325 mgr día), sobre todo en pacientes sometidos a revascularización endovascular o quirúrgica. El clopidogrel puede ser una alternativa en pacientes que no toleran el AAS o como tratamiento inicial.
Salvo en pacientes con síndrome coronario agudo sometidos a revascularización no hay evidencia de que la doble antiagregación (AAS + Clopidogrel) mejore la prevención secundaria de episodios cardiovasculares.
9.9.1.4 Medicación Vasodilatadora
Los estudios realizados con diferentes vasodilatadores han demostrado un nulo efecto terapéutico en pacientes con EAP, sin embargo el cilostazol, un fármaco con efecto vasodilatador y antiagregante, parece mejorar la distancia de claudicación en estos pacientes. El cilostazol (inhibidor de la fosfodiesterasa tipo III) ha demostrado también mejoría (mejoría de 43 m de media tras 20 semanas de tratamiento) en pacientes con claudicación intermitente (recomendación Clase I) y puede utilizarse como primer intento terapéutico pero hay que tener en cuenta su alta tasa de complicaciones (tasa de abandono del 60%) y estácontraindicado en pacientes con insuficiencia cardiaca congestiva.
Otros fármacos vasodilatadores como las Prostaglandinas (Beraprost o Iloprost) no han demostrado ser útiles ni por vía oral ni intravenosa para mejorar la claudicación o reducir la tasa de amputación y muerte en la isquemia crítica por lo que su uso no estárecomendado.
En estudios realizados con antagonistas del calcio no se ha encontrado mejoría en la claudicación con Nifedipino. Solo un estudio con Verapamilo ha demostrado mejoría en la distancia de claudicación en relación a placebo pero no se han vuelto a realizar nuevos estudios que lo confirmen.
9.9.1.5 Medicación Hemorreológica
La Pentoxifilina actúa aumentando el flujo sanguíneo tisular mediante la reducción de la viscosidad sanguínea y aumento de la deformidad de eritrocitos y leucocitos, inhibe la adhesión y activación de neutrófilos y disminuye el fibrinógeno plasmático. Además, al disminuir las resistencias periféricas, probablemente se vea favorecido el desarrollo de la circulación colateral.
Actualmente no se ha demostrado de forma concluyente su beneficio en la claudicación intermitente y no es útil en el tratamiento de la isquemia crítica. Se considera un fármaco de segunda fila como sustituto del cilostazol en el tratamiento de la claudicación (recomendación clase IIb).
Fig.14 Fármacos
9.9.1.6 Medicación anticoagulante
Los anticoagulantes orales no han demostrado eficacia en tratamiento de la claudicación y se asocian a alto riesgo de hemorragia. Las heparinas en sus diversas formas (sódica, cálcica, bajo peso molecular) están prácticamente limitadas a las formas agudas o críticas de la isquemia. El uso de dicumarínicos queda, en la práctica, reservado para casos particulares de especial trombogenicidad (FA, válvula cardiaca metálica, TVP,…) y deben asociarse en los pacientes con EAP a AAS a bajas dosis.
9.9.1.7 Otros Fármacos
Se están realizando estudios con fármacos que aumenten el metabolismo oxidativo muscular (L-carnitina y Propionil L-), factores de crecimiento angiogénicos y células madres que todavía están en fase de investigación y valoración de primeros resultados.
Tratamientos alternativos como L-Arginina, la vitamina E o el EDTA se desaconsejan en la EAP. Plantas como el Ginko Biloba han demostrado un beneficio marginal en la mejoría de la claudicación intermitente.
En el tratamiento farmacológico vascular actual la antiagregación estáindicada para prevención de eventos cardiovasculares sistémicos y para tratamiento de la claudicación la primera indicación es el cilostazol 100 mg cada 12 horas y como segunda línea la Pentoxifilina 600 mg cada 12 horas. La isquemia crítica suele precisar tratamiento endovascular o quirúrgico para revascularización de la extremidad.
9.9.2 Tratamiento quirúrgico
Formalmente la cirugía vascular moderna comienza en 1947 cuando el cirujano portugués J. Cid dos Santos realizóuna endarterectomía en una femoral aterosclerótica. Cuatro años después se realiza en San Francisco la misma técnica pero en la región aortoilíaca al mismo tiempo que el francés Kunlin practicaba el primer by-pass con vena en la extremidad inferior. Diez años más tarde se empezaron a utilizar los primeros injertos sintéticos en aorta y by-pass con vena a los vasos tibiales.
9.9.2.1 Técnicas hiperemiantes
Fundamentalmente la simpatectomía lumbar, que en símisma no debe plantearse como tratamiento primario de una claudicación en miembros inferiores, pero que en casos seleccionados puede mejorar los síntomas al aumentar el flujo cutáneo. Hoy día es una técnica en desuso.
9.9.2.2 Técnicas de revascularización directa
Se basan en la actuación directa sobre la arteria lesionada para eliminar directamente la placa de ateroma responsable de la obstrucción (tromboendarterectomía) o que pueden mejorar el flujo colateral (profundoplastias). Especial importancia tiene la cirugía derivativa (by-pass) con la realización de puentes que saltan la zona obstruida mediante la utilización de injertos autólogos (vena safena), heterólogos, xenoinjertos o prótesis sintéticas (Dacron, PTFE, …).
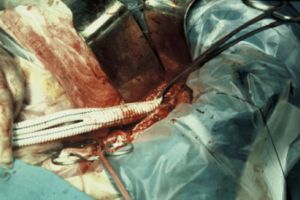
En el sector aortoilíaco la técnica derivativa es la principal indicación quirúrgica, especialmente el by-pass aortobifemoral, con una permeabilidad inicial prácticamente del 100%, mas del
80% a los 5 años y 75% a los 10 años. Se realiza bajo anestesia general, laparotomía media para exposición de la aorta infrarenal e incisión longitudinal en ambas ingles para exposición de arterias femorales. La mortalidad perioperatoria es del 4% y la supervivencia a 5 años es del 75%.
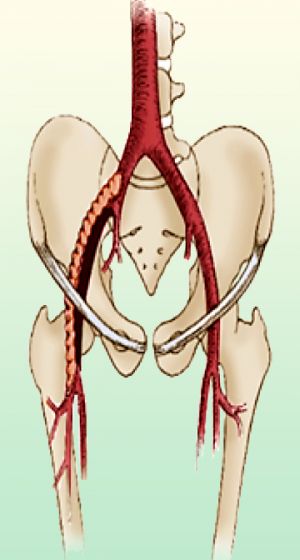
Fig 15. By-pass aortobifemoral
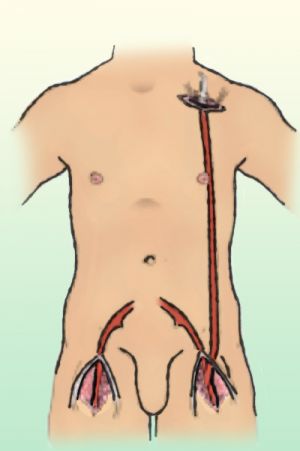
El by-pass axilo-bifemoral es una alternativa al anterior en pacientes con alto riesgo quirúrgico. Se suele realizar bajo anestesia general y se utiliza como donante una arteria axilar (la correspondiente al brazo que mayor TA tenga). El by-pass circula subcutáneo lo largo de la pared lateral de tórax y abdomen y las anastomosis distales se realizan en arterias femorales. Tiene baja morbimortalidad y la tasa de permeabilidad a los 5 años llega al 74% y la salvación de extremidad al 89%.
Fig 16. By-pass axilofemoral
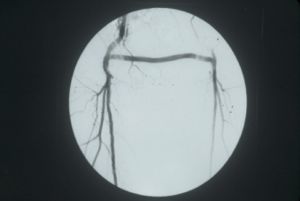
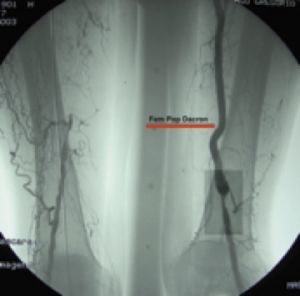
Fig. 17 Arteriografía By-pass fémoro-femoral
El by-pass femoro-femoral es una alternativa en pacientes con flujo conservado en aorta y uno de los ejes ilíacos con obstrucción del contralateral. Se realiza bajo anestesia raquídea o epidural y la prótesis corre subcutánea por la región suprapúbica entre ambas arterias femoles. Tiene una permeabilidad del 80% a los 5 años. Hoy en día la combinación de angioplastia o endoprótesis aórtica o ilíaca asociada a by-pass fémoro-femoral se ha mostrado como una alternativa cada vez más frecuente al by-pass aortobifemoral, especialmente en pacientes con riesgo quirúrgico alto.
El by-pass ílio-femoral es otra alternativa al by-pass aorto-bifemoral en pacientes con obstrucción limitada a la arteria ilíaca externa. Hoy día queda limitado a los casos en que un intento de revascularización percutáneo fracasa. La mortalidad es prácticamente 0 y la permeabilidad a 4 años es del 77%.
Fig. 18 Bypass iliofemoral
La cirugía laparoscópica o robótica de la aorta es defendida por algunos autores argumentando menor estancia hospitalaria, menor dolor post-operatorio y menos complicaciones pero en cambio son intervenciones mucho mas largas y con una dificultad técnica que obliga a largas curvas de aprendizaje. No es una técnica que tenga una aceptación generalizada hoy día.
La enfermedad arterial oclusiva en la región infrainguinal es la patología arterial que mas se diagnostica y trata en cirugía vascular. Hoy día se esperan tasas de mejoría clínica de la claudicación y de conservación de la extremidad del 80-90% en pacientes con isquemia crítica que precisan intervención quirúrgica. Un reciente estudio multicéntrico nos ha permitido conocer que la mortalidad perioperatoria en estas intervenciones es del 2,7% y la permeabilidad primaria 77%, la conservación de la extremidad 88% y la supervivencia a un año del 84%. Los malos resultados están directamente relacionados con pacientes > 75 años, diálisis, anemia, necrosis tisular previa y enfermedad coronaria. Las dos indicaciones principales para realizar cirugía de revascularización infrainguinal son la claudicación invalidante y la isquemia crítica.
La cirugía infrainguinal puede realizarse bajo anestesia regional, epidural, raquídea o general.
En general toda la cirugía derivativa (by-pass) infrainguinal obtiene mejores resultados con autoinjerto venoso, generalmente la vena safena interna homolateral. Esto es especialmente cierto en los by-pass que deban ir por debajo de la rodilla ya que los injertos sintéticos (poliéster o PTFE) tienen permeabilidades sensiblemente menores.
Los by-pass con vena safena invertida tienen hoy día unas tasas de permeabilidad primaria y secundaria del 75 y 80% respectivamente y un 90% de conservación de la extremidad.
Una variante del by-pass con vena safena invertida es el by-pass in situ donde la vena no se extrae e invierte sino que se se utiliza un dispositivo especial (valvulotomo) para romper las válvulas venosas y ambos extremos de la vena se suturan a los segmentos proximal y distal arteriales para construir el by-pass. Sus resultados son similares a los de vena invertida.
Fig. 19 By-pass femoropoplíteo con vena
En caso de que no se disponga de vena safena interna del mismo lado puede utilizarse la safena interna contralateral, la vena safena externa o las venas cefálica o basílica de las extremidades superiores. Las venas criopreservadas de cadáveres se reservan para casos extremos ya que su permeabilidad es mucho menor.
Fig. 20 By-pass femoropoplíteo con prótesis
Los injertos protésicos deben ser un recurso en la cirugía infrainguinal, pero en muchos centros si la anastomosis distal es en la arteria poplítea por encima de la rodilla y los vasos tibiales están permeables se opta por la prótesis ya que en estas circunstancias las tasas de permeabilidad son similares a las de los by-pass con vena. Los dos materiales que se utilizan en estos injertos son de poliéster (Dacron) y PTFE.
El fracaso temprano de los injertos (30 días) se considera que se produce por errores técnicos o de criterio de indicación, los fracasos intermedios (entre 30 días y 2 años) generalmente son causados por hiperplasia anastomótica o a nivel de las válvulas venosas. Las oclusiones tardías (> 2 años) se deben por lo general a progresión de la enfermedad aterosclerótica.
El seguimiento post-operatorio periódico con eco-doppler es útil para intentar detectar lesiones precozmente y solucionarlas antes de que el injerto se ocluya.
9.9.2.3 Amputación
El fracaso del tratamiento médico o de las técnicas quirúrgicas previamente descritas aboca, en ocasiones, a realizar amputaciones. A veces la amputación primaria es la solución mas segura y aconsejable en pacientes con isquemia irreversible, necrosis tisular y úlceras.
Fig. 21 Amputación abierta dedos
9.9.3 Técnicas endovasculares
Consistentes en la eliminación de estenosis u obstrucciones mediante la utilización de catéteres percutáneos que disponen de balones expansibles o mallas metálicas capaces de dilatar o repermeabilizar estos vasos.
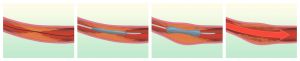
Fig. 22 Esquema de angioplastia con balón de una estenosis arterial
La elección de pacientes candidatos a tratamiento endovascular depende de criterios anatómicos y funcionales.
Los criterios anatómicos son: posibilidad de lograr un acceso vascular, posibilidad de atravesar la lesión con una guía y de poder avanzar un catéter terapéutico a través de la lesión.
La disponibilidad de endoprótesis autoexpandibles o balón expandibles ha aumentado el abanico de lesiones anatómicas tratables.
Fig. 23 Stent
Los criterios funcionales o clínicos son: la claudicación invalidante, isquemia crítica o isquemia aguda.
En los pacientes con claudicación, el tratamiento endovascular solo debe realizarse si previamente ha fracasado el tratamiento farmacológico con Cilostazol y el programa de ejercicio físico.
El estudio BASIL comparando tratamiento quirúrgico frente a endovascular en pacientes con isquemia crítica mostraba a los 6 meses la mismas tasas de amputación y supervivencia, pero los costes del tratamiento quirúrgico en el primer año eran mayores que los del tratamiento endovascular.
Las contraindicaciones relativas del tratamiento endovascular son: lesiones potencialmente ateroembólicas, lesiones no dilatables y que los beneficios del tratamiento no compensen el riesgo del procedimiento.
En todos estos procedimientos la única premedicación necesaria es el AAS porque no hay datos que apoyen que el uso de otros fármacos mejore el resultado del procedimiento endovascular. Tampoco hay datos que apoyen la doble antiagregación después del tratamiento.
Durante el procedimiento se suele anticoagular al paciente con una dosis en bolo de 5000 UI de heparina sódica.
Para realizar el procedimiento endovascular es fundamental primero planificar y conocer los abordajes vasculares adecuados al tipo y localización de las lesiones: radial, humeral, femoral o poplíteo y si se debe abordar de forma retrógrada o anterógrada.
En segundo lugar la elección del material se realiza buscando introductores y catéteres mas finos y de perfil mas bajo. Hoy en día existe una gran variedad de guías y catéteres con diferentes diámetros, longitudes, rigideces y formas de punta para adaptarse a las dificultades y características específicas de cada procedimiento.
Los resultados clínicos varían del sector a tratar y del tipo de lesión:
9.9.3.1 Sector aortoilíaco.
Es el territorio donde el tratamiento endovascular es la primera elección por tener menor morbimortalidad que la cirugía abierta y unos porcentajes de éxito técnico inicial del 98%, permeabilidad primaria a los 8 años del 74% y secundaria del 84%. Se ha podido comprobar que en estos resultados no influyen ni la edad, el tabaquismo, la diabetes o la hipertensión a los 10 años. Los mejores resultados se obtiene en lesiones en iliaca común y algo peores en iliaca externa.
Diversos estudios demuestras que es preferible tratar inicialmente las lesiones ilíacas con una endoprótesis primaria (stent) que con angioplastia con balón (recomendación clase I).
En estudios comparativos entre tratamiento con endoprótesis endovascular y cirugía en lesiones intermedias en ilíaca se ha comprobado que la supervivencia y la tasa de amputaciones eran similares a los 5 años pero la permeabilidad era mayor en el grupo quirúrgico, sin embargo en lesiones complejas el tratamiento endovascular presentómenor estancia hospitalaria, menor número de complicaciones, menor tasa de permeabilidad primaria y mayor de permeabilidad secundaria que el grupo quirúrgico.
Fig. 24 Estenosis ilíaca y resultado post stent
9.9.3.2 Sector femoropoplíteo
Los datos indican que las lesiones femoropoplíteas > 7 cm se benefician mas de endoprótesis mientras que en las <4 cm se obtienen buenos resultados con angioplastias de balón, dejando la endoprótesis como posibilidad de rescate en caso de complicación.
Las endoprótesis cubiertas se usan con buen resultado en el tratamiento de traumatismos y en los aneurismas. En lesiones estenosantes u oclusivas sus resultados son del 10% de trombosis a los 30 días, y permeabilidad primaria al año del 67%. La comparación con la cirugía muestra igual permeabilidad primaria y secundaria pero mejores resultados clínicos en las lesiones complejas en los tratados quirúrgicamente.
En los últimos años se ha añadido a balones y endoprótesis fármacos inhibidores del crecimiento neointimal responsable de las reestenosis. Inicialmente los estudios han sido negativos en caso de las endoprótesis y algo favorables en los casos de balones liberadores de fármacos.
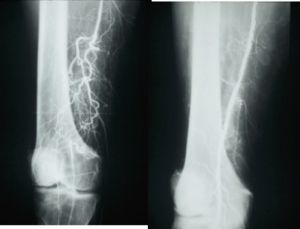
Fig. 25 Oclusión poplítea pre ATP y resultado tras ATP
9.9.3.3 Sector tíbioperonéo
Se usa solo en casos de isquemia crítica y muestra una tasa de éxito con angioplastia simple del 80% y porcentajes de conservación de la extremidad entre el 85 y 91% en periodos de 2 y 5 años.
Es imprescindible una adecuada selección de los pacientes y de las lesiones ya que los resultados son mejores en lesiones focales y menos de 5 lesiones por vaso.
No se ha demostrado utilidad en el uso de endoprótesis infrapoplíteas.
9.9.4 Técnicas de recurso
En ocasiones, antes de plantear una amputación se han utilizado dispositivos paliativos del dolor como la neuroestimulación permanente. Su utilidad es dudosa.
9.9.5 Comparación entre tratamiento endovascular y cirugía
El único estudio publicado con fuerza probatoria nivel 1 para comparar los resultados entre técnicas endovasculares y cirugía abierta es el BASIL ( Bypass versus Angoplasty in Severe Ischemia of the Legs ). El análisis de este estudio no encontródiferencias en supervivencia sin amputación entre ambos grupos pero síque la cirugía era mas cara a corto plazo. A largo plazo se pudo comprobar que ambos grupos presentan la misma supervivencia global y porcentaje de salvación de extremidad pero en los pacientes que sobrevivieron más de 2 años ( 70% de la población total estudiada ) la cirugía abierta logróaumentar la supervivencia global y una mayor tendencia a evitar la pérdida de la extremidad. También se encontróque la angioplastia primaria tiene un efecto negativo sobre posibles revascularizaciones quirúrgicas futuras.
Los autores llegaron a la conclusión que en pacientes con disponibilidad de autoinjerto venoso y esperanza de vida superior a 2 años es preferible la cirugía abierta.
9.10 Bibliografía
1. Medicina Vascular. Complemento de Braunwald. Tratado de Cardiología. 2ª Edición. Mark A. Greager, Joshua A. Beckman. Edt Elservier Saunders 2013.
2. Cirugía Vascular. Sexta Edición. Rutherford. Elservier Saunders 2006.
3. Suárez C, Lozano FS, coordinadores. Documento de Consenso Multidisciplinar en Enfermedad Arterial Periférica de Extremidades Inferiores. 1ª edición. Madrid 2012.
4. Standars of Medical Care in Diabetics. Diabetic Care 38:Supplement 1, Janaury 2015.
5. ESC Guidelines on the diagnosis and treatment of peripherical artery diseases. European heart Journal 32:2851-2906, 2011.Ness J, Aronow WS. Prevalence of coexistence of coronary artery disease,
6. Ness J, Aronow WS. Prevalence of coexistence of coronary artery disease, ischemic stroke, and peripheral arterial disease in older persons, mean age 80 years, in an academic hospital-based geriatrics practice. J Am Geriatr Soc 47:1255-1256, 1999.
7. Saw J, Bhatt DL, Moliterno DJ, Brener SJ, Steinhubl SR, Lincoff AM, Tcheng JE, Harrington RA, Simoons M, Hu T, Sheikh MA, Kereiakes DJ, Topol EJ. The influence of peripheral arterial disease on outcomes: a pooled analysis of mortality in eight large randomized percutaneous coronary intervention trials. J Am Coll Cardiol;48:1567–1572. 2006.
8. Hirsch AT, Criqui MH, Treat-Jacobson D, Regensteiner JG, Creager MA, Olin JW, Krook SH, Hunninghake DB, Comerota AJ, Walsh ME, McDermott MM, Hiatt WR. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA 2001;286:1317–1324.
9. España G. Enfermedad Vascular Periférica: Isquemia de Miembros Inferiores. En: Estudio de la Incapacidad Laboral por Enfermedades ardiocirculatorias. Capítulo 12. Sosa Rodríguez V (Coordinador). Editado por el Instituto Nacional de Medicina y Seguridad del Trabajo. Longares I y R S.A. Madrid, 1998. Pags: 163-172. ISBN: 84-351-0287-4.
10. Criqui MH, Langer RD, Fronek A, Feigelson HS, Klauber MR, McCann TJ, Browner D. Mortality over a period of 10 years in patients with peripheral arterial disease. N Engl J Med 1992;326:381–386.
11. McDermott MM, Greenland P, Liu K, Guralnik JM, Criqui MH, Dolan NC, Chan C, Celic L, Pearce WH, Schneider JR, Sharma L, Clark E, Gibson D, Martin GJ. Leg symptoms in peripheral arterial disease: associated clinical characteristics and functional impairment. JAMA 286:1599–16
12. Michal Tendera (Chairperson)* (Poland), Victor Aboyans (Co-Chairperson)* (France), Marie-Louise Bartelink (The Netherlands), Iris Baumgartner (Switzerland), Denis Cle´ment (Belgium), Jean-Philippe Collet (France), Alberto Cremonesi (Italy), Marco De Carlo (Italy), Raimund Erbel (Germany), F. Gerry R. Fowkes (UK), Magda Heras (Spain), Serge Kownator (France), Erich Minar (Austria), Jan Ostergren (Sweden), Don Poldermans (The Netherlands), Vincent Riambau (Spain), Marco Roffi(Switzerland), Joachim Ro¨ ther† (Germany), Horst Sievert (Germany), Marc van Sambeek (The Netherlands), Thomas Zeller (Germany). 06, 2001. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases. European Heart Journal 32, 2851-2906 2011.
13. Strategies to prevent and heal diabetic foot ulcers: building a partnership for amputation prevention. J vasc Surg 2010, 52, number 12S
14. Teodorescu V, Vavra A, Kibbe M. Peripheral arterial disease in womwn. J Vasc Surg, 57:18S-26S.
15. Leng GC, Fowkes FG. The Edinburgh Claudication Questionnaire: an improved version of the WHO/Rose Questionnaire for use in epidemiological surveys. J Clin Epidemiol 1992;45:1101–1109.
16. McDermott MM, Greenland P, Liu K, Guralnik JM, Criqui MH, Dolan NC, Chan C, Celic L, Pearce WH, Schneider JR, Sharma L, Clark E, Gibson D, Martin GJ. Leg symptoms in peripheral arterial disease: associated clinical characteristics and functional impairment. JAMA 2001;286:1599–1606.
17. Lijmer JG, Hunink MG, van den Dungen JJ, Loonstra J, Smit AJ. ROC analysis of noninvasive tests for peripheral arterial disease. Ultrasound Med Biol 1996;22: 391–398.
18. Stoffers HE, Kester AD, Kaiser V, Rinkens PE, Kitslaar PJ, Knottnerus JA. The diagnostic value of the measurement of the ankle–brachial systolic pressure index in primary health care. J Clin Epidemiol 1996;49:1401–1405.
19. Schroder F, Diehm N, Kareem S, Ames M, Pira A, Zwettler U, Lawall H, Diehm C. A modified calculation of ankle–brachial pressure index is far more sensitive in the detection of peripheral arterial disease. J Vasc Surg 2006;44: 531–536.
20. Stein R, Hriljac I, Halperin JL, Gustavson SM, Teodorescu V, Olin JW. Limitation of the resting ankle–brachial index in symptomatic patients with peripheral arterial disease. Vasc Med 2006;11:29–33.
21. Aboyans V, Ho E, Denenberg JO, Ho LA, Natarajan L, Criqui MH. The association between elevated ankle systolic pressures and peripheral occlusive arterial disease in diabetic and nondiabetic subjects. J Vasc Surg 2008;48:1197–1203.
22. Hiatt WR, Cox L, Greenwalt M, Griffin A, Schechter C. Quality of the assessment of primary and secondary endpoints in claudication and critical leg ischemia trials. Vasc Med 2005;10:207–213.
23. Ouriel K, McDonnell AE, Metz CE, Zarins CK. Critical evaluation of stress testing in the diagnosis of peripheral vascular disease. Surgery 1982;91:686–693.
24. Dormandy JA, Rutherford RB. Management of peripheral arterial disease (PAD). TASC Working Group. TransAtlantic Inter-Society Consensus (TASC). J Vasc Surg 2000;31:S1–S296.
25. Visser K, Hunink MG. Peripheral arterial disease: gadolinium-enhanced MR angiography versus color-guided duplex US—a meta-analysis. Radiology 2000; 216:67–77.
26. Collins R, Cranny G, Burch J, Aguiar-Ibanez R, Craig D, Wright K, Berry E, Gough M, Kleijnen J, Westwood M. A systematic review of duplex ultrasound, magnetic resonance angiography and computed tomography angiography for the diagnosis and assessment of symptomatic, lower limb peripheral arterial disease. Health Technol Assess 2007;11:iii–iv, xi–xiii, 1–184.
27. Koelemay MJ, Legemate DA, van Gurp JA, de Vos H, Balm R, Jacobs MJ. nterobserver variation of colour duplex scanning of the popliteal, tibial and pedal arteries. Eur J Vasc Endovasc Surg 2001;21:160–164.
28. Bandyk DF, Chauvapun JP. Duplex ultrasound surveillance can be worthwhile after arterial intervention. Perspect Vasc Surg Endovasc Ther 2007;19:354–359; discussion 360–351.
29. Ferris BL, Mills JL Sr, Hughes JD, Durrani T, Knox R. Is early postoperative duplex scan surveillance of leg bypass grafts clinically important? J Vasc Surg 2003;37:495–500.
30. Ouwendijk R, de Vries M, Stijnen T, Pattynama PM, van Sambeek MR, Buth J, Tielbeek AV, van der Vliet DA, SchutzeKool LJ, Kitslaar PJ, de Haan MW, van Engelshoven JM, Hunink MG. Multicenter randomized controlled trial of the costs and effects of noninvasive diagnostic imaging in patients with peripheral arterial disease: the DIPAD trial. AJR Am J Roentgenol 2008;190:1349–1357.
31. Hingorani A, Ascher E, Marks N. Preprocedural imaging: new options to reduce need for contrast angiography. Semin Vasc Surg 2007;20:15–28.
32. Met R, Bipat S, Legemate DA, Reekers JA, Koelemay MJ. Diagnostic performance of computed tomography angiography in peripheral arterial disease: a systematic review and meta-analysis. JAMA 2009;301:415–424.
33. Poon E, Yucel EK, Pagan-Marin H, Kayne H. Iliac artery stenosis measurements: comparison of two-dimensional time-of-flight and three-dimensional dynamic gadolinium-enhanced MR angiography. AJR Am J Roentgenol 1997;169: 1139–1144.
34. Ho KY, de Haan MW, Kessels AG, Kitslaar PJ, van Engelshoven JM. Peripheral vascular tree stenoses: detection with subtracted and nonsubtracted MR angiography. Radiology 1998;206:673–681.
35. Quinn SF, Sheley RC, Semonsen KG, Leonardo VJ, Kojima K, Szumowski J. Aortic and lower-extremity arterial disease: evaluation with MR angiography versus conventional angiography. Radiology 1998;206:693–701.
36. Nelemans PJ, Leiner T, de Vet HC, van Engelshoven JM. Peripheral arterial disease: meta-analysis of the diagnostic performance of MR angiography. Radiology 2000;217:105–114.
37. Koelemay MJ, Lijmer JG, Stoker J, Legemate DA, Bossuyt PM. Magnetic resonance angiography for the evaluation of lower extremity arterial disease: a meta-analysis. JAMA 2001;285:1338–1345.
38. Clement DL, Van Maele GO, De Pue NY. Critical evaluation of venous occlusion plethysmography in the diagnosis of occlusive arterial diseases in the lower limbs. Int Angiol 1985;4:69–74.
39. Watson L, Ellis B, Leng GC. Exercise for intermittent claudication. Cochrane Database Syst Rev 2008;4:CD000990.
40. GBendermacher BL, Willigendael EM, Teijink JA, Prins MH. Supervised exercise therapy versus non-supervised exercise therapy for intermittent claudication. Cochrane Database Syst Rev 2006;2:CD005263.
41. Hiatt WR, Wolfel EE, Meier RH, Regensteiner JG. Superiority of treadmill walking exercise versus strength training for patients with peripheral arterial disease. Implications for the mechanism of the training response. Circulation1994;90:1866–1874.
42. Hodges LD, Sandercock GR, Das SK, Brodie DA. Randomized controlled trial of supervised exercise to evaluate changes in cardiac function in patients with peripheral atherosclerotic disease. Clin Physiol Funct Imaging 2008;28:32–37. 2902 ESC Guidelines
43. Claeys R, Bogaert M, Clement D. Study on the non-drug, conservative treatment of intermittent claudication. T Geneeskunde 1982;38:585–588.
44. Treat-Jacobson D, Bronas UG, Leon AS. Efficacy of arm-ergometry versus treadmill exercise training to improve walking distance in patients with claudication. Vasc Med 2009;14:203–213.
45. Pande RL, Hiatt WR, Zhang P, Hittel N, Creager MA, McDermott M. A pooled analysis of the durability and predictors of treatment response of cilostazol in patients with intermittent claudication. Vasc Med 2010;15:181–188.
46. Momsen AH, Jensen MB, Norager CB, Madsen MR, Vestersgaard-Andersen T, Lindholt JS. Drug therapy for improving walking distance in intermittent claudication: a systematic review and meta-analysis of robust randomised controlled studies. Eur J Vasc Endovasc Surg 2009;38:463–474.
47. O’Donnell ME, Badger SA, Sharif MA, Young IS, Lee B, Soong CV. The vascular and biochemical effects of cilostazol in patients with peripheral arterial disease. J Vasc Surg 2009;49:1226–1234.
48. Lehert P, Comte S, Gamand S, Brown TM. Naftidrofuryl in intermittent claudication: a retrospective analysis. J Cardiovasc Pharmacol 1994;23 Suppl 3:S48–S52.
49. De Backer T, Vander Stichele R, Lehert P, Van Bortel L. Naftidrofuryl for intermittent claudication: meta-analysis based on individual patient data. BMJ 2009; 338:b603.
50. Spengel F, Clement D, Boccalon H, Liard F, Brown T, Lehert P. Findings of the Naftidrofuryl in Quality of Life (NIQOL) European study program. Int Angiol 2002;21:20–27.
51. Brevetti G, Diehm C, Lambert D. European multicenter study on propionyl-L-carnitine in intermittent claudication. J Am Coll Cardiol 1999;34: 1618–1624.
52. Hiatt WR, Regensteiner JG, Creager MA, Hirsch AT, Cooke JP, Olin JW, Gorbunov GN, Isner J, Lukjanov YV, Tsitsiashvili MS, Zabelskaya TF, Amato A. Propionyl-L-carnitine improves exercise performance and functional status in patients with claudication. Am J Med 2001;110:616–622.
53. Leizorovicz A, Becker F. Oral buflomedil in the prevention of cardiovascular events in patients with peripheral arterial obstructive disease: a randomized, placebo-controlled, 4-year study. Circulation 2008;117:816–822.
54. de Backer TL, Bogaert M, Vander Stichele R. Buflomedil for intermittent claudication. Cochrane Database Syst Rev 2008;1:CD000988.
55. De Backer TL, Vander Stichele RH, Van Bortel LM. Bias in benefit–risk appraisal in older products: the case of buflomedil for intermittent claudication. Drug Saf 2009;32:283–291.
56. De Buyzere ML, Clement DL. Management of hypertension in peripheral arterial disease. Prog Cardiovasc Dis 2008;50:238–263.
57. Shahin Y, Mazari F, Chetter I. Do angiotensin converting enzyme inhibitors improve walking distance in patients with symptomatic lower limb arterial disease? A systematic review and meta-analysis of randomised controlled trials. Int J Surg 2011;9:209–213.
58. Bogaert MG, Clement DL. Lack of influence of propranolol and metoprolol on walking distance in patients with chronic intermittent claudication. Eur Heart J 1983;4:203–204.
59. Paravastu SC, Mendonca DA, da Silva A. Beta blockers for peripheral arterial
60. disease. Eur J Vasc Endovasc Surg 2009;38:66–70.
61. Nicolai SP, Kruidenier LM, Bendermacher BL, Prins MH, Teijink JA. Ginkgo biloba for intermittent claudication. Cochrane Database Syst Rev 2009;2: CD006888.
62. Labropoulos N, Wierks C, Suffoletto B. Intermittent pneumatic compression for the treatment of lower extremity arterial disease: a systematic review. Vasc Med 2002;7:141–148.
63. de Haro J, Acin F, Florez A, Bleda S, Fernandez JL. A prospective randomized controlled study with intermittent mechanical compression of the calf in patients with claudication. J Vasc Surg 2010;51:857–862.
64. Diehm N, Baumgartner I, Jaff M, Do DD, Minar E, Schmidli J, Diehm C, Biamino G, Vermassen F, Scheinert D, van Sambeek MR, Schillinger M. A call for uniform reporting standards in studies assessing endovascular treatment for chronic ischaemia of lower limb arteries. Eur Heart J 2007;28:798–805.
65. Spronk S, Bosch JL, den Hoed PT, Veen HF, Pattynama PM, Hunink MG. Intermittent claudication: clinical effectiveness of endovascular revascularization versus supervised hospital-based exercise training—randomized controlled trial. Radiology 2009;250:586–595.
66. Klein WM, van der Graaf Y, Seegers J, Moll FL, Mali WP. Long-term cardiovascular morbidity, mortality, and reintervention after endovascular treatment in patients with iliac artery disease: The Dutch Iliac Stent Trial Study. Radiology 2004;232:491–498.
67. Kashyap VS, Pavkov ML, Bena JF, Sarac TP, O’Hara PJ, Lyden SP, Clair DG. The management of severe aortoiliac occlusive disease: endovascular therapy rivals open reconstruction. J Vasc Surg 2008;48:1451–1457.
68. Grenacher L, Rohde S, Ganger E, Deutsch J, Kauffmann GW, Richter GM. In vitro comparison of self-expanding versus balloon-expandable stents in a human ex vivo model. Cardiovasc Intervent Radiol 2006;29:249–254.
69. Tetteroo E, van der Graaf Y, Bosch JL, van Engelen AD, Hunink MG, Eikelboom BC, Mali WP. Randomised comparison of primary stent placement versus primary angioplasty followed by selective stent placement in patients with iliac-artery occlusive disease. Dutch Iliac Stent Trial Study Group. Lancet 1998;351:1153–1159.
70. Schillinger M, Sabeti S, Dick P, Amighi J, Mlekusch W, Schlager O, Loewe C, Cejna M, Lammer J, Minar E. Sustained benefit at 2 years of primary femoropopliteal stenting compared with balloon angioplasty with optional stenting. Circulation 2007;115:2745–2749.
71. Dick P,Wallner H, Sabeti S, Loewe C, Mlekusch W, Lammer J, Koppensteiner R, Minar E, Schillinger M. Balloon angioplasty versus stenting with nitinol stents in intermediate length superficial femoral artery lesions. Catheter Cardiovasc Interv 2009;74:1090–1095.
72. Scheinert D, Scheinert S, Sax J, Piorkowski C, Braunlich S, Ulrich M, Biamino G, Schmidt A. Prevalence and clinical impact of stent fractures after femoropopliteal stenting. J Am Coll Cardiol 2005;45:312–315.
73. Duda SH, Bosiers M, Lammer J, Scheinert D, Zeller T, Oliva V, Tielbeek A, Anderson J, Wiesinger B, Tepe G, Lansky A, Jaff MR, Mudde C, Tielemans H, Beregi JP. Drug-eluting and bare nitinol stents for the treatment of atherosclerotic lesions in the superficial femoral artery: long-term results from the SIROCCO trial. J Endovasc Ther 2006;13:701–710.
74. Tepe G, Zeller T, Albrecht T, Heller S, Schwarzwalder U, Beregi JP, Claussen CD, Oldenburg A, Scheller B, Speck U. Local delivery of paclitaxel to inhibit restenosis during angioplasty of the leg. N Engl J Med 2008;358: 689–699.
75. Kedora J, Hohmann S, Garrett W, Munschaur C, Theune B, Gable D. Randomized comparison of percutaneous Viabahn stent grafts vs prosthetic femoral–popliteal bypass in the treatment of superficial femoral arterial occlusive disease. J Vasc Surg 2007;45:10–16.
76. Laird JR, Katzen BT, Scheinert D, Lammer J, Carpenter J, Buchbinder M, DaveR, Ansel G, Lansky A, Cristea E, Collins TJ, Goldstein J, Jaff MR; RESILIENTInvestigators. Nitinol stent implantation versus balloon angioplasty for lesions in the superficial femoral artery and proximal popliteal artery: twelve-month results from the RESILIENT randomized trial. Circ Cardiovasc Interv 2010;3:267–276.
77. Ferraresi R, Centola M, Ferlini M, Da Ros R, Caravaggi C, Assaloni R, Sganzaroli A, Pomidossi G, Bonanomi C, Danzi GB. Long-term outcomes after angioplasty of isolated, below-the-knee arteries in diabetic patients with critical limb ischaemia. Eur J Vasc Endovasc Surg 2009;37:336–342.
78. Conrad MF, Kang J, Cambria RP, Brewster DC, Watkins MT, Kwolek CJ, LaMuraglia GM. Infrapopliteal balloon angioplasty for the treatment of chronic occlusive disease. J Vasc Surg 2009;50:799–805.
79. Siablis D, Karnabatidis D, Katsanos K, Diamantopoulos A, Spiliopoulos S, Kagadis GC, Tsolakis J. Infrapopliteal application of sirolimus-eluting versus bare metal stents for critical limb ischemia: analysis of long-term angiographic and clinical outcome. J Vasc Interv Radiol 2009;20:1141–1150.
80. Chiu KW, Davies RS, Nightingale PG, Bradbury AW, Adam DJ. Review of directanatomical open surgical management of atherosclerotic aorto-iliac occlusive disease. Eur J Vasc Endovasc Surg 2010;39:460–471.
81. Twine CP, McLain AD. Graft type for femoro-popliteal bypass surgery. Cochrane Database Syst Rev 2010;5:CD001487.
82. Griffiths GD, Nagy J, Black D, Stonebridge PA. Randomized clinical trial of distal anastomotic interposition vein cuff in infrainguinal polytetrafluoroethylene bypass grafting. Br J Surg 2004;91:560–562.
83. SCAMICOS. PTFE bypass to below-knee arteries: distal vein collar or not? A prospective randomised multicentre study. Eur J Vasc Endovasc Surg 2010;39:747–754.
84. Takagi H, Goto SN, Matsui M, Manabe H, Umemoto T. A contemporary meta-analysis of Dacron versus polytetrafluoroethylene grafts for femoropopliteal bypass grafting. J Vasc Surg 2010;52:232–236.
85. Johnson WC, Lee KK. A comparative evaluation of polytetrafluoroethylene,umbilical vein, and saphenous vein bypass grafts for femoral–popliteal aboveknee revascularization: a prospective randomized Department of Veterans Affairs cooperative study. J Vasc Surg 2000;32:268–277.
86. Bradbury AW, Adam DJ, Bell J, Forbes JF, Fowkes FG, Gillespie I, Ruckley CV, Raab GM; BASIL TrialParticipants. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial: an intention-to-treat analysis of amputation-free and overall survival in patients randomized to a bypass surgery-first or a balloon angioplasty-first revascularization strategy. J Vasc Surg 2010;51:5S–17S. ESC Guidelines 2903
87. Adam DJ, Beard JD, Cleveland T, Bell J, Bradbury AW, Forbes JF, Fowkes FG, Gillepsie I, Ruckley CV, Raab G, Storkey H. Bypass versus angioplasty in severe ischaemia of the leg (BASIL): multicentre, randomised controlled trial. Lancet 2005;366:1925–1934.
88. Bradbury AW, Adam DJ, Bell J, Forbes JF, Fowkes FG, Gillespie I, Ruckley CV, Raab GM; BASIL TrialParticipants. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial: a survival prediction model to facilitate clinical decisión making. J Vasc Surg 2010;51:52S–68S.
89. Diehm N, Schillinger M, Minar E, Gretener S, Baumgartner I. TASC II section E3 on the treatment of acute limb ischemia: commentary from European interventionists. J Endovasc Ther 2008;15:126–128.
90. Bandyk DF. Surveillance after lower extremity arterial bypass. Perspect Vasc Surg Endovasc Ther 2007;19:376–383.
91. Davies AH, Hawdon AJ, Sydes MR, Thompson SG; VGSTParticipants. Is dúplex surveillance of value after leg vein bypass grafting? Principal results of the Vein Graft Surveillance Randomised Trial (VGST). Circulation 2005;112:1985–1991.
92. Brumberg RS, Back MR, Armstrong PA, Cuthbertson D, Shames ML, Johnson BL, Bandyk DF. The relative importance of graft surveillance and warfarin therapy in infrainguinal prosthetic bypass failure. J Vasc Surg 2007;46:1160–1166.
93. Brown J, Lethaby A, Maxwell H, Wawrzyniak AJ, Prins MH. Antiplatelet agentsfor preventing thrombosis after peripheral arterial bypass surgery. Cochrane Database Syst Rev 2008;4:CD000535.
94. Efficacy of oral anticoagulants compared with aspirin after infrainguinal bypass surgery (The Dutch Bypass Oral Anticoagulants or Aspirin Study): a randomised trial. Lancet 2000;355:346–351.
95. Johnson WC, Williford WO; Department of Veterans Affairs Cooperative Study #362. Benefits, morbidity, and mortality associated with long-term administration of oral anticoagulant therapy to patients with peripheral arterial bypass procedures: a prospective randomized study. J Vasc Surg 2002;35:413–421.
96. Belch JJ, Dormandy J, CASPAR Writing Committee, Biasi BM, Cairols M, Diehm C, Eikelboom B, Golledge J, Jawien A, Lepantalo M, Norgren L, Hiatt WR, Becquemin JP, Bergqvist D, Clement D, Baumgartner I, Minar E, Stonebridge P, Vermassen F, Matyas L, Leizorovicz A. Results of the randomized, placebo-controlled clopidogrel and acetylsalicylic acid in bypass surgery for peripheral arterial disease (CASPAR) trial. J Vasc Surg 2010;52:825–833, 833 e821–822.
97. Dagher NN, Modrall JG. Pharmacotherapy before and after revascularization: anticoagulation, antiplatelet agents, and statins. Semin Vasc Surg 2007;20:10–14.
98. Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, Amano K, Kishimoto Y, Yoshimoto K, Akashi H, Shimada K, Iwasaka T, Imaizumi T. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet 2002;360:427–435.
99. Kusumanto YH, van Weel V, Mulder NH, Smit AJ, van den Dungen JJ, Hooymans JM, Sluiter WJ, Tio RA, Quax PH, Gans RO, Dullaart RP, Hospers GA. Treatment with intramuscular vascular endothelial growth factor gene compared with placebo for patients with diabetes mellitus and critical limb ischemia: a double-blind randomized trial. Hum Gene Ther 2006;17: 683–691.
100. Nikol S, Baumgartner I, Van Belle E, Diehm C, Visona A, Capogrossi MC, Ferreira-Maldent N, Gallino A, Wyatt MG, Wijesinghe LD, Fusari M, Stephan D, Emmerich J, Pompilio G, Vermassen F, Pham E, Grek V, Coleman M, Meyer F. Therapeutic angiogenesis with intramuscular NV1FGF improves amputation-free survival in patients with critical limb ischemia. Mol Ther 2008;16:972–978.
101. Shigematsu H, Yasuda K, Iwai T, Sasajima T, Ishimaru S, Ohashi Y, Yamaguchi T, Ogihara T, Morishita R. Randomized, double-blind, placebo-controlled clinical trial of hepatocyte growth factor plasmid for critical limb ischemia. Gene Ther 2010;17:1152–1161.
102. Rajagopalan S, Mohler ER 3rd, Lederman RJ, Mendelsohn FO, Saucedo JF, Goldman CK, Blebea J, Macko J, Kessler PD, Rasmussen HS, Annex BH. Regional angiogenesis with vascular endothelial growth factor in peripheral arterial disease: a phase II randomized, double-blind, controlled study of adenoviral delivery of vascular endothelial growth factor 121 in patients with disabling intermittent claudication. Circulation 2003;108:1933–1938.
103. Grossman PM, Mendelsohn F, Henry TD, Hermiller JB, Litt M, Saucedo JF, Weiss RJ, Kandzari DE, Kleiman N, Anderson RD, Gottlieb D, Karlsberg R, Snell J, Rocha-Singh K. Results from a phase II multicenter, double-blind placebocontrolled study of Del-1 (VLTS-589) for intermittent claudication in subjects with peripheral arterial disease. Am Heart J 2007;153:874–880.
104. Huang PP, Yang XF, Li SZ, Wen JC, Zhang Y, Han ZC. Randomised comparisonof G-CSF-mobilized peripheral blood mononuclear cells versus bone marrowmononuclearcells for the treatment of patients with lower limb arteriosclerosis obliterans. Thromb Haemost 2007;98:1335–1342.
105. Sprengers RW, Moll FL, Verhaar MC. Stem cell therapy in PAD. Eur J Vasc Endovasc Surg 2010;39 Suppl 1:S38–S43.
106. Belch J, Hiatt WR, Baumgartner I, Driver IV, Nikol S, Norgren L, Van Belle E; onbehalf of the TAMARIS Committees and Investigators. Effect of fibroblastgrowth factor NV1FGF on amputation and death: a randomized placebocontrolledtrial of gene therapy in critical limb ischaemia. Lancet 2011;377: 1929–1937.
107. Greenhalgh RM, Belch JJ, Brown LC, Gaines PA, Gao L, Reise JA, Thompson SG. The adjuvant benefit of angioplasty in patients with mild to moderate intermittent claudication (MIMIC) managed by supervised exercise, smoking cessation advice and best medical therapy: results from two randomised trials for stenotic femoropopliteal and aortoiliac arterial disease. Eur J Vasc Endovasc Surg 2008;36: 680–688.
108. Murphy TP, Hirsch AT, Ricotta JJ, Cutlip DE, Mohler E, Regensteiner JG, Comerota AJ, Cohen DJ; CLEVER Steering Committee. The Claudication: Exercise Vs. Endoluminal Revascularization (CLEVER) study: rationale and methods. J Vasc Surg 2008;47:1356–1363.
109. Diehm C, Lange S, Darius H, Pittrow D, von Stritzky B, Tepohl G, Haberl RL, Allenberg JR, Dasch B, Trampisch HJ. Association of low ankle brachial index with high mortality in primary care. Eur Heart J 2006;27:1743–1749.
110. Slovut DP, Sullivan TM. Critical limb ischemia: medical and surgical management. Vasc Med 2008;13:281–291.
111. Rutherford RB, Baker JD, Ernst C, Johnston KW, Porter JM, Ahn S, Jones DN. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997;26:517–538.
112. Heart Protection Study Collaborative Group. Randomized trial of the effects of cholesterol-lowering with simvastatin on peripheral vascular and other major vascular outcomes in 20,536 people with peripheral arterial disease and other high-risk conditions. J Vasc Surg 2007;45:645–654.
113. Catalano M, Born G, Peto R. Prevention of serious vascular events by aspirin amongst patients with peripheral arterial disease: randomized, double-blind trial. J Intern Med 2007;261:276–284.
114. Dick F, Diehm N, Galimanis A, Husmann M, Schmidli J, Baumgartner I. Surgical or endovascular revascularization in patients with critical limb ischemia: influence of diabetes mellitus on clinical outcome. J Vasc Surg 2007;45:751–761.
115. Lawrence PF, Chandra A. When should open surgery be the initial option for critical limb ischaemia? Eur J Vasc Endovasc Surg 2010;39 Suppl 1:S32–S37.
116. Van Damme H, Zhang L, Baguet E, Creemers E, Albert A, Limet R. Crural artery bypass with the autogenous greater saphenous vein. Eur J Vasc Endovasc Surg 2003;26:635–642.
117. Pomposelli FB, Kansal N, Hamdan AD, Belfield A, Sheahan M, Campbell DR, Skillman JJ, Logerfo FW. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J Vasc Surg 2003;37: 307–315.
118. Conte MS, Geraghty PJ, Bradbury AW, Hevelone ND, Lipsitz SR, Moneta GL, Nehler MR, Powell RJ, Sidawy AN. Suggested objective performance goals and clinical trial design for evaluating catheter-based treatment of critical limb ischemia. J Vasc Surg 2009;50:1462–1473.
119. Taylor SM, Cull DL, Kalbaugh CA, Cass AL, Harmon SA, Langan EM 3rd, Youkey JR. Critical analysis of clinical success after surgical bypass for lowerextremity ischemic tissue loss using a standardized definition combining multiple parameters: a new paradigm of outcomes assessment. J Am Coll Surg 2007;204: 831–838.
120. Creutzig A, LehmacherW, Elze M. Meta-analysis of randomised controlled prostaglandin E1 studies in peripheral arterial occlusive disease stages III and IV. Vasa2004;33:137–144.
121. Ruffolo AJ, Romano M, Ciapponi A. Prostanoids for critical limb ischaemia. Cochrane Database Syst Rev 2010;1:CD006544.
122. Ubbink DT, Vermeulen H. Spinal cord stimulation for non-reconstructable chronic critical leg ischaemia. Cochrane Database Syst Rev 2005;3:CD004001.
123. Sobel M, Verhaeghe R. Antithrombotic therapy for peripheral artery occlusive disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008;133:815S–843S.
124. Wijns W, Kolh P, Danchin N, Di Mario C, Falk V, Folliguet T, Garg S, Huber K, James S, Knuuti J, Lopez-Sendon J, Marco J, Menicanti L, Ostojic M, Piepoli MF, Pirlet C, Pomar JL, Reifart N, Ribichini FL, Schalij MJ, Sergeant P, Serruys PW, Silber S, Sousa Uva M, Taggart D, Vahanian A, Auricchio A, Bax J, Ceconi C, Dean V, Filippatos G, Funck-Brentano C, Hobbs R, Kearney P, McDonagh T, Popescu BA, Reiner Z, Sechtem U, Sirnes PA, Tendera M, Vardas PE, Widimsky P, Alfieri O, Dunning J, Elia S, Kappetein P, Lockowandt U, Sarris G, Vouhe P, von Segesser L, Agewall S, Aladashvili A, Alexopoulos D, Antunes MJ, Atalar E, Brutel de la Riviere A, Doganov A, Eha J, Fajadet J, Ferreira R, Garot J, Halcox J, Hasin Y, Janssens S, Kervinen K, Laufer G, Legrand V, Nashef SA, Neumann FJ, Niemela K, Nihoyannopoulos P, Noc M, Piek JJ, Pirk J, Rozenman Y, Sabate M, Starc R, Thielmann M, Wheatley DJ, Windecker S, Zembala M. Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2010;31:2501–2555.
125. Cupples LA, Gagnon DR, Wong ND, Ostfeld AM, Kannel WB. Preexisting cardiovascular conditions and long-term prognosis after initial myocardial infarction:
126. The Framingham Study. Am Heart J 1993;125:863–872.
127. Alberts MJ, Bhatt DL, Mas JL, Ohman EM, Hirsch AT, Rother J, Salette G, Goto S, Smith SC Jr, Liau CS, Wilson PW, Steg PG; REduction of Atherothrombosis for Continued Health Registry Investigators. Three-year follow-up and event rates in the international REduction of Atherothrombosis for Continued Health Registry. Eur Heart J 2009;30:2318–2326.
128. Ferrieres J, Cambou JP, Gayet JL, Herrmann MA, Leizorovicz A. Prognosis of patients with atherothrombotic disease: a prospective survey in a non-hospital setting. Int J Cardiol 2006;112:302–307.