Capítulo 4 - TC y RM: Principios básicos y utilidad en la patología vascular
4.1 Tomografía Computarizada (TC)
En el año 1972 el ingeniero inglés Hounsfield construyó el primer equipo de tomografía computarizada. El deseo de utilizar ésta para el estudio de las estructuras vasculares es tanantiguocomo la misma técnica.
Este sueño se hace realidad casi 30 años después de la introducción del método en la práctica clínica diaria.
Para una correcta evaluación de las estructuras vasculares es necesaria una gran resolución temporal, que se obtiene a través de una adquisición rápida de las imágenes, para evitar los artefactos de movimiento (respiratorios, cardiacos y del paciente) y una gran resolución espacial, para diferenciar adecuadamente las pequeñas estructuras vasculares y poder incluir grandes volúmenes del cuerpo en una sola adquisición.
En la época de la tomografía computarizada convencional las limitaciones técnicas eran la causa de la larga duración del tiempo de adquisición, la búsqueda de soluciones técnicas a este problema llevó a su progresivo acortamiento desde 300 s en el año 1972 a 2 s en el año 1992.
En el año 1998 se introducen los equipos multidetectores que permiten la adquisición de cuatro cortes con grosor de 1,25 mm solo en 500 ms y es cuando realmente empieza la época de la imagen vascular. El rápido desarrollo técnico llevó a la aparición de equipos de 16 detectores en el año 2002, de 64 detectores en el año 2004 y en el año 2006, de equipos de 320 detectores. Los avances técnicos no solo permiten la adquisición de más cortes en una rotación sino acortamiento del tiempo de rotación a 270 ms y del grosor del corte de hasta 0,5 mm. Con los equipos contemporáneos el tiempo de adquisición de todo el cuerpo es de 10 s. Los nuevos equipos multidetectores consiguen la realización de exámenes con muy alta resolución espacial en comparación con los estudios de resonancia magnética y ecografía y la adquisición en plano axial permite obviar la superposición de estructuras tridimensionales en su presentación bidimensional, como ocurre con los métodos radiológicos convencionales. También permite diferenciar las partes blandas y realizar una valoración cuantitativa de parámetros estructurales así como la posibilidad de realizar reconstrucciones posteriores multiplanares, tridimensionales y diversas modalidades de post procesado con alta calidad.
4.1.1 Principios Básicos de la TC
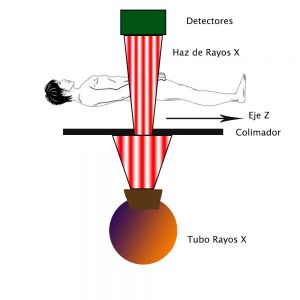
Los equipos de TC utilizan los rayos X para la adquisición de imágenes de un objeto tridimensional. La medición de los rayos X con una misma orientación por parte de todos los detectores se denomina proyección. La TC realiza múltiples proyecciones con diferente orientación alrededor del objeto para conseguir la imagen tomográfica. Los rayos X se generan del tubo de rayos X con ánodo de wolframio que se sitúa en la carcasa. Los detectores se encuentran en el mismo soporte mecánico, enfrente del tubo de rayos X. El tubo y los detectores se desplazan de forma sincrónica alrededor del paciente. Para la creación de la tensión necesaria se utiliza un generador de alta tensión igualmente colocado en la carcasa adyacente al tubo de rayos X. La potencia máxima de los equipos actuales está entre 60-120 kW, con valores de tensión entre 80 y 40kV. Los electrones se aceleran desde el cátodo hacia el ánodo (diana). Cuando los electrones acelerados alcanzan la diana, interactúan con ella y producen un haz de rayos X con morfología en abanico. Con el aumento de las filas de detectores el haz adquiere forma cónica y en los equipos de TC volumétrico, con hasta 320 detectores, permite abarcar un volumen de interés completo. En los equipos helicoidales, mientras el tubo de rayos X está activado y girando alrededor del paciente, éste está inmóvil. Después del disparo de rayos X la camilla se desplaza y se realiza una nueva activación del tubo y así consecutivamente. Los rayos X atraviesan el cuerpo del paciente, son atenuados por los tejidos de éste y a continuación, son captados por los detectores colocados en el lado opuesto del tubo de rayos X .
Fig.1 Representación esquemática de la tomografía computarizada
Un ordenador convierte los valores obtenidos de cada proyección en una imagen bidimensional donde cada pixel tiene por intensidad un valor estimado de su atenuación. Para realizar esta asignación se pueden utilizar métodos analíticos o iterativos. Los métodos analíticos son ampliamente usados y se basan en un sistema de ecuaciones lineales, la retroproyección y la retroproyección filtrada. Los métodos iterativos incluyen el método iterativo algebraico y el método iterativo estadístico.
En los últimos años se han desarrollado equipos TC helicoidales multidetectores (TCMD) y doble fuente. En estos aparatos, mediante el uso de dos diferentes voltajes del tubo de rayos X, se crean dos haces en abanico con diferente energía, al menos uno de ellos con cobertura completa del campo de interés. Estos haces se pueden conseguir mediante el uso de dos tubos de rayos X dispuestos perpendicularmente con sus correspondientes detectores separados o mediante una sola fuente que puede realizar cambio rápido del voltaje con detectores en capas o lectura de datos en diferente punto temporal que permite a los detectores diferenciar las distintas energías aportadas. Los kilovoltajes utilizados suelen ser de 80 kV y 140kV. Cuando se emplea una misma energía se obtienen valores de atenuación determinados para los diferentes tejidos, mientras que con el uso de dos energías se consiguen diferencias en la atenuación, especialmente en tejidos con alto número atómico como el yodo, el calcio o el ácido úrico. De esta forma, se aporta información adicional que permite una mejor diferenciación entre ciertos tejidos. En la práctica clínica, permite realizar la substracción del yodo y la creación de un estudio virtual basal realizando una sola adquisición con contraste yodado lo que resultaría en una menor dosis para el paciente en comparación con los exámenes multifásicos, con dos o tres adquisiciones con una sola energía del haz, con menos dosis de contraste intravenoso. También, facilita la eliminación de las estructuras óseas y de las placas calcificadas resultando menos laborioso el post procesado y la interpretación de las imágenes.
Con la introducción de los equipos actuales de TCMD se pueden obtener grandes volúmenes anatómicos en un tiempo muy corto que conlleva una mejora en la resolución espacial y temporal y disminución de los artefactos por movimiento (respiratorio, latido cardiaco, peristalsis intestinal). A partir de los datos base se puede modificar el grosor del corte mejorando la resolución espacial. El desarrollo de programas de postprocesado como reconstrucciones multiplanares (MPR), proyección de máxima intensidad (MIP) y volumen de reproducción (VR) mejoran el poder diagnóstico de los exámenes y permite nuevas aplicaciones clínicas como la angiografía mediante TC.
El importante desarrollo técnico de los equipos de TCMD ha conseguido reducir el tiempo de adquisición y mejorar la resolución espacial, no obstante ha sido a costa de importante aumento de las dosis de radiación impartidas a los pacientes con respecto a la técnica de un corte, que pueden llegar a ser de hasta un 40% para cada examen. Esto obliga al desarrollo de técnicas que permiten reducir la dosis en TC .
A la hora de programar el examen el radiólogo dis¬pone de varias herramientas para conseguir minimizar la dosis de radiación asociada a las exploraciones de TCMD empezando por una indicación clínica correcta para la realización del examen. Entre las estrategias disponibles está la adap¬tación individual de mAs mediante aplicacio¬nes de control automático de exposición. Otra medida simple para reducir la radiación es disminuir los kilovoltios (kV) según el peso y el tamaño del paciente ya que la dosis de radiación varía proporcionalmente con el cuadrado del voltaje del tubo. Los métodos de descomposición de materias de los equipos de doble energía permiten la creación de estudio basal virtual y de sustracción ósea con una sola adquisición con contraste intravenoso que podría reducir la dosis de radiación en comparación con los estudios vasculares trifásicos convencionales. En los últimos años, gracias al desarrollo de potentes ordenadores, las diferentes casas comerciales han incorporado algoritmos de re¬construcción iterativa que permiten la formación de imágenes con dosis de radiación más bajas y similares niveles de ruido y de calidad de la imagen en comparación con la retropro¬yección filtrada. En estos casos la reducción de la dosis se basa en la adquisición con valores reducidos de mA. Más iteraciones tienen como resultado me¬jor calidad de imagen pero también precisan mayor potencia de cálculo y tiempo de procesado, por lo que la capacidad de realizar las reconstrucciones iterativas depende en gran medida del tiempo dispuesto a asumir por cada estudio y la capacidad de proce¬sado gráfico de la consola del equipo de to¬mografía computarizada.
4.1.2 Utilidad de la TC en la Patología Vascular
La TC está ampliamente presente en el ámbito hospitalario y la rapidez de realización y la calidad de los exámenes la convierten en la técnica de elección para la evaluación radiológica de los pacientes con patología vascular aguda y clínicamente inestables. Sus principales limitaciones son el uso de radiación ionizante, de contrate yodado nefrotóxico y la ausencia de información hemodinámica. Para una adecuada interpretación del estudio es imprescindible la utilización de técnicas de post procesado (MPR, MIP y VR).
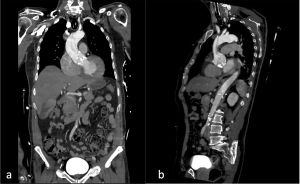
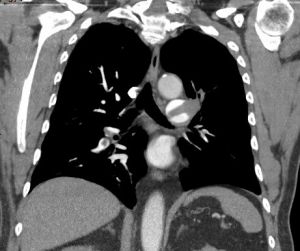
La TC tiene una sensibilidad y especificidad cercana al 100% en el diagnóstico de las diferentes entidades del síndrome aórtico agudo y condiciona la actitud quirúrgica. Las adquisiciones multifásicas tras la administración de contraste intravenoso permiten la identificación de la puerta de entrada y posibles reentradas, la extensión de la afectación de la pared aórtica, diferenciación de la luz verdadera y la luz falsa y una adecuada valorización de los principales troncos arteriales.
Fig. 2 TC con contraste intravenoso reconstrucción MIP coronal (a) y sagital (b). Se identifica colgajo intimal con trayecto espiroideo que se extiende desde el plano valvular hasta el origen del tronco braquicefálico y salida de la arteria coronaria derecha de la luz falsa.
Permite valorar la presencia de calcificaciones, placas de ateroma, trombo mural, manguito perivascular y colecciones de vecindad así como el resto de los órganos y estructura del cuerpo y puede detectar patologías extravasculares.
Fig. 3 Reconstrucción 3D VR (a). Se visualiza imagen sacular en cara lateral de la aorta ascendente a la altura de la salida del tronco braquiocefálico y otra en la cara lateral de la aorta descendente, distal al origen de la arteria subclavia izquierda correspondientes a ulceras penetrantes. TC axial con contraste intravenoso (b) muestra detalle de la ulceración en aorta torácica y reconstrucción MIP sagital oblicua (c) con detalle de la úlcera en aorta descendente.
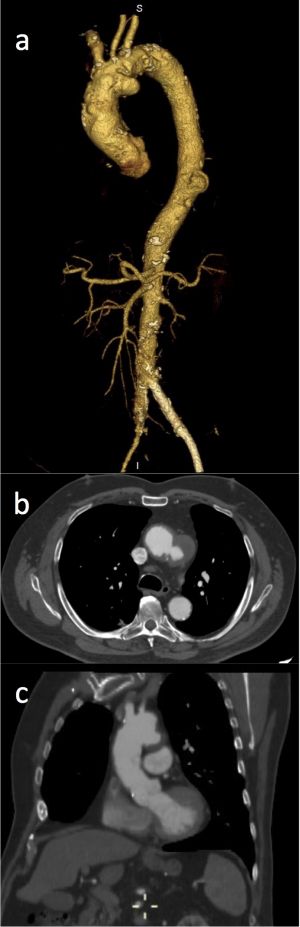
La angio-TC es una técnica precisa que puede detectar la patología aneurismática de aorta torácica y abdominal y aporta información detallada sobre las dimensiones del aneurisma, complicaciones isquémicas o sangrado, afectación de las arterias renales, mesentéricas e ilíacas y es parte importante en la evaluación preoperatoria. También es la técnica indicada para la detección de complicaciones postquirúrgicas de las prótesis aórticas.
Fig. 4 TC con contraste intravenoso reconstrucción MIP coronal (a) y sagital (b). Se identifica prótesis aortobiiliaca con endofuga tipo I.
La angio-TC es la prueba de elección en el estudio del tromboembolismo pulmonar (TEP). Con una adecuada técnica de administración de contraste intravenoso consigue la opacificación óptima del árbol arterial pulmonar y es posible la detección de defectos de repleción en los vasos subsegmentarios.
Fig. 5 . Angio-TC con contraste intravenoso, reconstrucción MIP. Defectos de repleción en la arteria pulmonar principal izquierda y ramas lobares superior izquierda, inferior derecha y del LM.
La sensibilidad de la TC helicoidal para el diagnóstico de TEP central es de 100% disminuyendo para los vasos segmentarios. Las técnicas de postprocesado permiten diferenciar el trombo arterial del volumen parcial de la pared bronquial, artefactos de movimiento o ganglios linfáticos. En un examen de angio-TC para el diagnóstico de TEP también se incluye la caja torácica y las estructura contenidas en ella y puede ofrecer diagnósticos alternativos. De forma opcional se puede añadir examen de venografía-TC de pelvis y miembros inferiores utilizando la misma inyección de contraste intravenoso. Los exámenes de angio-TC con doble energía aportan información adicional sobre la perfusión pulmonar.
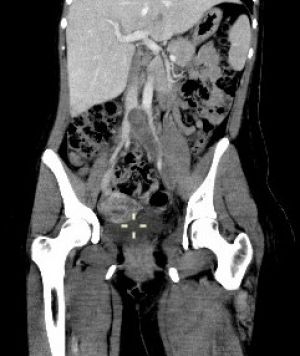
La angio-TC es técnica de referencia en el diagnóstico de la isquemia mesentérica aguda, una patología con clínica inespecífica y con alta mortalidad asociada. Con una sola inyección de contraste intravenoso se pueden realizar adquisiciones en fase arterial y venosa y evaluar en el mismo examen los vasos mesentéricos tanto arteriales como venosos y los órganos sólidos (Fig. 6). Las diferentes técnicas de postprocesado permiten identificar el lugar exacto del trombo vascular y ayudan a elegir la técnica quirúrgica así como tienen carácter pronóstico. En la patología ateromatosa de la arteria mesentérica superior la angio-TC puede identificar estenosis superiores al 50% y oclusiones y valorar la circulación colateral.
Fig. 6. Angio-TC con contraste intravenoso en fase venosa. Gran defecto de repleción en vena cava inferior y arteria iliaca común izquierda.
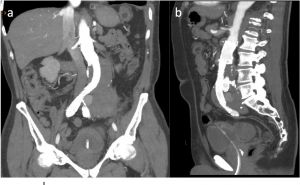
Con la técnica de angio-TC se pueden valorar específicamente las arterias renales en el estudio de HTA, pretrasplante y en la evaluación del trasplante renal. Puede valorar tanto los vasos arteriales como venoso, su morfología, trayecto, presencia de vasos accesorios y su número y valorar posibles estenosis. En el mismo examen puede valorar estructuras extravasculares y detectar patología adrenal, renal o pancreática de la HTA.
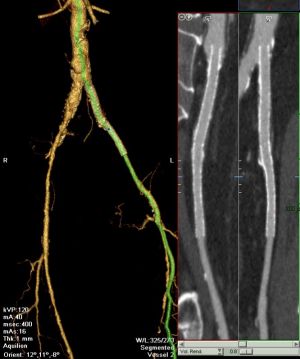
La angio-TC es una alternativa no invasiva a la angiografía por sustracción digital (DSA por sus siglas en inglés) en el diagnóstico de la patología arterial vascular periférica obstructiva. Actualmente los equipos de TCMD pueden adquirir grandes volúmenes (desde la aorta torácica hasta los pies) con una sola adquisición de contraste intravenoso y en una sola fase (arterial o venosa) según las necesidades clínicas. La sensibilidad y la especificidad para detectar estenosis severas son de 92 y 97% respectivamente y para oclusiones de 89 y 98%. Se pueden evaluar placas ateromatosas y su repercusión sobre la luz vascular, la luz de las prótesis endovasculares y puentes vasculares, complicaciones de la cirugía vascular y las estructuras extravsaculares.
Fig. 7. Angio-TC de MMII con contraste intravenoso, reconstrucciones 3D VR. Múltiples estenosis suboclusivas y oclusión en arteria femoral superficial derecha con desarrollo de circulación colateral y permeabilización distal a partir de la arteria poplítea.
Fig. 8. Análisis de la luz de prótasis endovascular.
Esta técnica está exenta de las complicaciones propias de una técnica invasiva como la DSA y prácticamente la está sustituyendo como prueba diagnóstica tanto en casos agudos como crónicos. Su valor diagnóstico disminuye en la presencia de extensas calificaciones vasculares, sobre todo en los vasos distales de pequeño calibre.
Igualmente se está convirtiendo en la técnica de elección en el estudio de los troncos supraaórticos. Puede valorar todo el trayecto cervical de las arterias carótidas, desde su origen. Con esta técnica se pueden analizar las placas de ateroma, detectar placas en tándem, identificar la presencia de ulceraciones y estenosis de la luz vascular. Ayuda a la decisión entre tratamiento quirúrgico y endovascular. Existen ciertas dificultades para diferenciar entre estenosis moderadas y severas con esta técnica con tendencia a subestimación.
Fig. 9. Angio-TC de TSA. Placa blanda en ACI derecha que condiciona estenosis de alrededor de 65% con clínica. Reconstrucción 3VR (a), detalle axial de la placa blanda (b) y análisis de la luz vascular (c).
La angio-TC permite visualizar tanto las estructuras vasculares como las partes blandas y estructuras óseas adyacentes y puede identificar causas del síndrome del estrecho torácico superior. No obstante, dado que se trata de una patología en un grupo de pacientes jóvenes y la dosis de radiación y contraste yodado que supone este estudio la técnica se queda relevada a un segundo lugar, después de la angio-RM. Ambas técnicas son superiores a la angiografía convencional.
4.2 Resonancia Magnética (RM)
En 1971 el doctor Raymond Damadian demostró que la resonancia magnética podía ser usada para detectar enfermedades ya que distintos tipos de tejidos emiten señales, que varían en su duración, en respuesta al campo magnético y creó el primer equipo de resonancia magnética en 1972.
4.2.1 Principios Básicos de la Resonancia Magnética (RM)
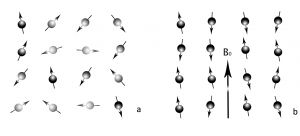
Para la creación de la imagen la resonancia magnética utiliza los átomos del hidrógeno presentes en el cuerpo humano. Cuando estos se colocan en un campo magnético, ellos se orientan a la dirección del campo como pequeños dipolos. La aplicación de un pulso adicional de radiofrecuencia (RF) con frecuencia determinada aporta energía a los átomos y algunos de ellos se orientan en una dirección diferente. La interrupción del pulso de RF permite a los átomos volver a su estado inicial y durante este proceso ellos emiten energía bajo la forma de señal de radiofrecuencia. La señal utilizada por la RM es la de los protones de hidrógeno de las moléculas de agua y grasa del cuerpo. Estos protones así como los núcleos de algunos otros átomos y el resto de las partículas elementales tienen la propiedad de espín, que es la causa de su comportamiento como pequeños imanes. Cuando se colocan en un campo magnético externo estos protones (o espines) se orientan o bien en dirección paralela a la del campo magnético o bien en dirección contraria, antiparalela, a la dirección del campo magnético.
Fig. 10 Distribución de los protones en un campo magnético – orientación paralela y antiparalela. El número de los protones con dirección paralela es mayor (b).
La dirección antiparalela necesita más energía que la orientación paralela por lo que la mayoría de los protones se orientan de forma paralela y crean su propio campo magnético en el cuerpo – magnetización neta. La diferencia en la energía es proporcional a la fuerza del campo magnético exterior, pero la energía de los campos magnéticos utilizados en la práctica clínica es pequeña y por esto, la diferencia en el número de los protones con orientación paralela y la fuerza de la magnetización neta también es pequeña. Esto obliga al uso de antenas sensibles y al incremento de la señal para la composición de imágenes.
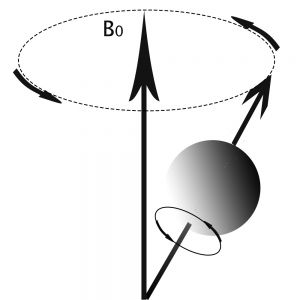
Cuando los protones son colocados en un campo magnético no solo se orientan según la dirección del campo sino que empiezan a realizar un movimiento rotatorio (precesión) alrededor de su eje y alrededor del eje de campo magnético de forma similar al movimiento del giroscopio. La frecuencia de este movimiento conocida como frecuencia de Larmor, es directamente proporcional a la intensidad del campo magnético generado por el imán externo:
ω=γBo
Donde ω es la frecuencia de precesión en Mhz, γ la constante giromagnética nuclear típica para cada núcleo ya que depende de su carga y cuyo valor para el hidrógeno es de 42,5 Mhz/T y Bo es la intensidad del campo magnético.
Fig.11 Al aplicar un campo magnético el protón realiza movimiento de precesión alrededor de su propio eje y alrededor del eje del campo magnético.
Como resultado el vector magnético de cada espín que realiza movimiento de precesión puede representarse como dos componentes separados, longitudinal, orientado en la dirección del campo magnético y transversal, con orientación perpendicular al eje del campo magnético constante. El vector longitudinal de cada protón es constante y está orientado de forma paralela o antiparalela y como el número de espines precisando en sentido paralelo es mayor, los vectores magnéticos de los espines se suman y el vector resultante es paralelo al campo magnético y su intensidad depende de la diferencia entre el número de protones orientados en sentido paralelo y el número de protones orientados en sentido antiparalelo y recibe el nombre de magnetización longitudinal neta (M.)
Por otra parte, el componente transversal de cada protón cambia su dirección en el tiempo con la frecuencia igual a la frecuencia de Larmor. En estado de equilibrio, en el sistema de protones los componentes transversales se orientan de forma aleatoria y se anulan entre sí y la magnetización transversal neta es 0.
Los protones pueden ser excitados mediante la aplicación de un pulso corto de RF. La frecuencia del pulso debe coincidir con la frecuencia de precesión de los protones. La energía del pulso de RF permite a algunos de los protones con estado de energía más bajo (paralelos) pasar a un estado de energía más alto (antiparalelo) lo que conlleva a reducción de la magnetización longitudinal neta. Por otro lado el pulso de RF sincroniza la fase de precesión de los diferentes protones y sus vectores tienen la misma dirección en cada momento, sus espines se suman y se forma un vector resultante llamado magnetización neta transversal orientado perpendicular al campo magnético. La energía del pulso de RF desvía al vector de la magnetización longitudinal neta con respecto al eje del campo magnético. El ángulo de esta desviación se denomina ángulo alfa y depende de la amplitud y de la duración del pulso de RF (90º o 180º).
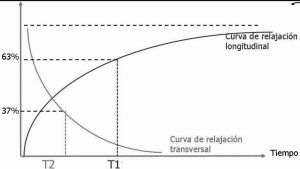
Al interrumpir el pulso de RF los protones empiezan a regresar a su estado inicial de equilibrio y la magnetización longitudinal neta se va recuperando y la magnetización transversal se va perdiendo. En este proceso liberan parte de la energía aportada por el pulso de RF generando una señal en forma de corriente eléctrica. Ésta es registrada en la antena receptora en forma de una sinusoide decreciente llamada caída libre de la inducción con frecuencia igual a la frecuencia de Larmor e induce una corriente en la antena receptora que puede ser ampliada, procesada y transformada en imagen. El tiempo de caída de la señal es conocido como tiempo de relajación transversal o T2. La relajación transversal T2 es una propiedad fundamental de cada tejido y se acorta con disminución de la homogeneidad del campo (mayor interacción espín- espín – T2*) El tiempo que transcurre entre que se envía el pulso de RF y se recoge la señal se denomina tiempo de eco (TE). La recuperación del vector de magnetización longitudinal neta también tiene su duración, característica para cada tejido. Este tiempo se denomina tiempo de relajación longitudinal (T1) y es más largo que T2 (Fig. 12). Ambos son característicos de cada tejido.
Fig. 12. T1 y T2 son constantes que describen los procesos de relajación transversal y longitudinal. El T1 es el tiempo que un tejido tarda en recuperar el 63% de la magnetización longitudinal volviendo a su estado de equilibrio y la T2 es el tiempo que un tejido pierde 63 % de su magnetización transversal.
Según la elección de los parámetros de la exploración se pueden obtener imágenes que tengan mayor predominio de T1 o de T2. TR corto y TE corto define la imagen potenciada en T1, TR largo y TE corto la imagen potenciada en DP y TR y TE largos la imagen potenciada en T2.
Además del pulso de RF las técnicas de imagen por RM utilizan gradientes de campo magnético para crear una diferenciación espacial en los tres ejes en la región estudiada. Los gradientes de campo magnético son campos magnéticos muy débiles que varían con la posición y que se superponen al campo magnético principal. La forma más habitual de generar gradientes es mediante pares de bobinas que se encuentran en el túnel de la máquina y son la fuente del ruido y de la vibración durante el proceso y se enfrían habitualmente con agua o aire. Una bobina de RF genera el pulso necesario para la excitación de los protones. La creación de un campo magnético con fuerza suficiente requiere un imán superconductor y necesita temperaturas muy bajas conseguidas con helio líquido.
Para la creación de la imagen por RM el paciente se coloca en el campo magnético constante del equipo. Mediante un pulso de RF se excitan los protones en la zona de interés. En cada excitación se actúa sobre un pequeño volumen de protones. Esto se consigue aportando cierta inhomogeneidad del campo magnético. El pulso de RF se interrumpe y empieza el proceso de relajación durante el cual los protones emiten señal que es registrada. Suele ser necesarias más de una excitación para recibir información de toda la zona estudiada. Los datos se procesan para recibir una imagen codificada en el espacio.
La RM es cada vez más utilizada en la patología vascular. La angio-RM trata de crear contraste entre la sangre y los tejidos estáticos. El estudio vascular con RM se basa en el uso de secuencias de sangre negra (SN) y sangre blanca (SB).
Las secuencias convencionales en los estudios angiográficos de RM 2D y 3D TOF (Time of Flight) o contraste de fase se basan en las diferencias de tejidos en movimiento (sangre) y estáticos cuando son sometidos a pulsos con tiempo de repetición corto. Estos pulsos impiden la relajación del tejido estacionario y eliminan su señal. La secuencia TOF permite diferenciar entre flujo arterial y venoso. Las secuencias de contraste de fase 2D y cine permiten cuantificar la velocidad de flujo. Las limitaciones de estas secuencias son el tiempo largo de adquisición y con frecuencia se ven artefactadas por movimientos y no son diagnósticas aunque el desarrollo actual de técnicas con adquisición en paralelo puede reducir la duración. En caso de flujos lentos y turbulentos y en vasos paralelos al plano de estudio condiciona pérdida de señal. Los avances técnicos como la adquisición permiten el desarrollo de nuevas secuencias angiográficas (IFIR), más rápidas y sin necesidad de contraste intravenoso.
Las secuencias potenciadas en SN con doble inversión recuperación permiten la valoración de la pared vascular y placas de ateroma.
El estudio angio-RM se puede completar con secuencias con administración de contraste intravenoso de gadolinio. El gadolinio reduce el T1 y permite conseguir gran contraste con los tejidos adyacentes. Se utilizan secuencias en eco de gradiente 3D (FLASH; SPGR; T1 FFE, True FISP, Balanced FEE y FIESTA) muy potenciadas en T1. Con estas secuencias se evitan las limitaciones de las secuencias convencionales de duración, flujo turbulento, vasos tortuosos. Son secuencias rápidas y requieren de apnea solo en la imagen torácica y permiten la obtención de grandes volúmenes de interés.
4.2.2 Utilidad de la RM en la Patología Vascular
La técnica de la angio-RM necesita tiempo para las adquisiciones de las imágenes y no es adecuada para utilizar con pacientes críticos. La presencia de marcapasos, desfribiladores implantables, clips ferromagnéticos de aneurismas cerebrales, material metálico en sitios de importancia vital o en equipos de soporte vital y neuroestimuladores no extraíbles contraindican su uso. El gadolinio se relaciona con la fibrosis nefrogénica sistémica y su uso está contraindicado en los pacientes con una tasa de filtrado glomerular < a 30 ml/min, en pacientes con insuficiencia renal aguda y en el preoperatorio del trasplante hepático.
La angio-RM puede ser utilizada para pacientes con patología vascular aguda (SAA) en pacientes hemodinámicamente estables y para aclarar exámenes no concluyentes con estudio de TC. En pacientes embarazadas debe ser valorada individualmente la relación beneficio/riesgo.
En pacientes estables con SAA, igual que la TC, la RM permite identificar la puerta de entrada y posibles reentradas, extensión de la enfermedad, identificar la luz falsa y la luz verdadera y la dependencia de los principales troncos arteriales de ellas. Aporta información adicional con la valoración de parámetros funcionales como insuficiencia aórtica y cuantificación del flujo en las luces aórticas. Se puede realizar sincronización con ECG y evitar los artefactos por latido cardiaco. Los equipos de TC actuales también permiten sincronización con ECG, a veces a costa de aumento de la dosis de radiación. Es útil en el seguimiento de los pacientes con SAA o en pacientes con dilataciones aneurismáticas que no tienen indicaciones de tratamiento quirúrgico o endovascular. Es la técnica recomendada en pacientes que van a necesitar estudios de revisión múltiples o tienen insuficiencia renal.
Fig. 13. Angio- RM 3D para control de aneurisma de aorta torácica ascendente.
En cuanto al estudio de la enfermedad tromboembólica pulmonar los desarrollos técnicos permiten realizar secuencias cortas y estudios tridimensionales reduciendo los artefactos por el movimiento respiratorio y cardiaco consiguiendo adecuada visualización del árbol arterial pulmonar. Es imprescindible el uso de técnicas de postprocesado para analizar cada arteria pulmonar hasta las ramas subsegmentarias. La sensibilidad de la angio RM para defectos segmentarios entre 78 y 99% y la especificidad de 95-98% y disminuye para defectos periféricos. La angio RM es igual de precisa que la angio TC en la valoración del TEP crónico identificando de forma precisa el afilamiento vascular. Es posible estudiar la ventilación pulmonar con gases nobles hiperpolarizados. La angio RM está limitada por la resolución espacial de la técnica y no es suficiente para el diagnóstico de trombos subsegmetnarios. La presencia de patología pulmonar (atelectasias, infiltrados) o derrame pleural puede limitar la visualización de los vasos pulmonares así como la superposición de arterias y venas. La RM está indicada en pacientes con alergia a los contrastes yodados así como en mujeres embarazadas y pacientes jóvenes y en pacientes con riesgo intermedio para TEP.
La angio-RM es la técnica de elección para el estudio de las arterias renales. No obstante su uso es todavía limitado debido al elevado coste y limitada accesibilidad a los equipos. Puede realizarse en pacientes en estudio por HTA o previamente a intervención endovascular. La sensibilidad para la detección de estenosis de la arteria renal en la angio-RM es del 92% y la especificidad del 64% .
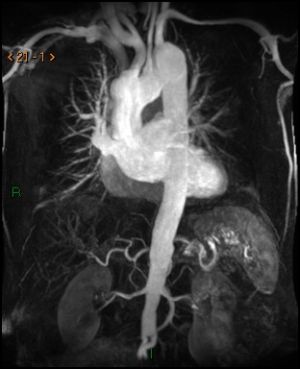
Fig.14. Angio-RM 3D de aorta abdominal
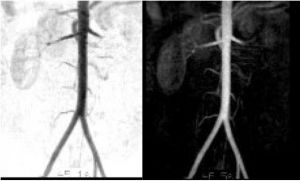
La angio-RM es una alternativa no invasiva de la DSA en la valoración de la patología vascular periférica. Es una prueba que consume mucho tiempo, pero tiene la ventaja de no utilizar radiaciones ionizantes ni contraste yodado y se puede utilizar en pacientes con intolerancia al yodo. Tiene sensibilidad y especificidad entre 92 y 97% pero tiende a sobreestimar las lesiones inferiores al 50%. Esta técnica es subóptima para la valoración de los troncos distales debido a la limitada resolución espacial y tampoco puede valorar la luz de las prótesis endovasculares debido a artefactos de vacío de señal.
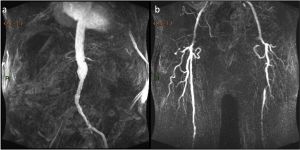
Fig. 15. Angio- RM de aneurisma de aorta abdominal con prótesis aortouniiliaca (a). Angio- RM de MMII demuestra estenosis significativas en arterias iliaca externa derecha y femoral superficial izquierda.
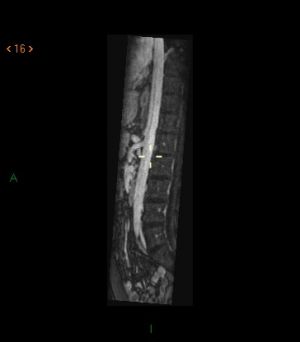
Las adquisiciones dinámicas permiten valorar las estructuras venosas y está técnica encuentra utilidad en el diagnóstico del síndrome de la pinza aortomesentérica.
Fig. 16. Angio-RM 3D sagital, permite adecuada valoración del ángulo aortomesentérico y del diámetro de la vena renal izquierda.
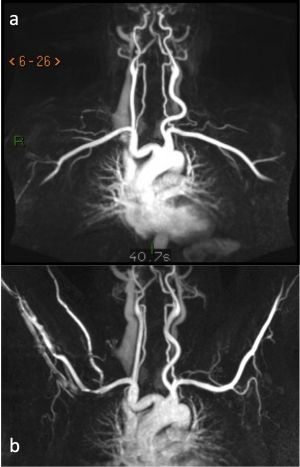
La angio-RM es la técnica de elección en el estudio del síndrome del estrecho torácico superior. Con esta técnica se puede obtener un adecuado mapa vascular tanto arterial como venoso. Ofrece una excelente caracterización de las partes blandas de la zona así como de las estructuras nerviosas y la limitación de la técnica reside en la visualización de las estructuras óseas. Se pueden realizar reconstrucciones multiplanares y localizar la estenosis vascular e identificar la causa en ausencia de radiación ionizante y contraste nefrotóxico.
Fig. 17. Angio-RM 3D del estrecho torácico superior. Estudio angiográfico arterial obtenido con los brazos en posición neutra con calibre conservado de las arterias (a). Estudio angiográfico arterial obtenido con los brazos en abducción demuestra estenosis subclavia a la altura del pectoral (b).
La angio-RM es una alternativa real a la angiografía invasiva para el estudio de los TSA e igual que la angio-TC puede dar información decisiva para el tratamiento endovascular y quirúrgico, presencia de estenosis significativas, lesiones en tandém, diferenciación entre estenosis crítica y oclusión y puede aportar información adicional sobre la dirección del flujo y caracterización de la placa de ateroma.
La radiología está en constante desarrollo y los avances tecnológicos cambian constantemente las aplicaciones clínicas de las diferentes técnicas radiológicas. Para el clínico es importante conocer las indicaciones y limitaciones de cada técnica y así, junto con el radiólogo, poder ofrecer una asistencia óptima al paciente.
4.3 Bibliografía
1. Ascenti G, Mazziotti S, Lamberto S, Bottari A, Caloggero S, Racchiusa S, et al. Dual-energy CT for detection of endoleaks after endovascular abdominal aneurysm repair: usefulness of colored iodine overlay. AJR Am J Roentgenol 2011;196:1408-14.
2. Bakker, J., Beek, F. J., Beutler, J. J., Hene, R. J., De Kort, G. A., de Lange, E. E., ... & Mali, W. P. Renal artery stenosis and accessory renal arteries: accuracy of detection and visualization with gadolinium-enhanced breath-hold MR angiography. Radiology 1998; 207(2), 497-504.
3. Brown, M. A., & Semelka, R. C. MRI: basic principles and applications. 2011;John Wiley & Sons.
4. Duddalwar, V. A. Multislice CT angiography: a practical guide to CT angiography in vascular imaging and intervention. Br J Radiol 2004; 77 Spec No 1: S27-38.
5. Calzado A, Geleijns J Tomografía computarizada. Evolución, principios técnicos y aplicaciones.Rev Fis Med 2010;11(3):163-180
6. Charon, J. P., Milne, W., Sheppard, D. G., & Houston, J. G. Evaluation of MR angiographic technique in the assessment of thoracic outlet syndrome. Clin Radiol 2004, 59(7), 588-595.
7. Demondion X, Herbinet P, Van Sint Jan S, Boutry N, Chantelot Ch, Cotten A. Imaging assessment of thoracic outlet syndrome. Radiographics. 2006; 26:1735-1750. , 2009.
8. Donato, A. A., Khoche, S., Santora, J., & Wagner, B. Clinical outcomes in patients with isolated subsegmental pulmonary emboli diagnosed by multidetector CT pulmonary angiography. Thromb Res 2010; 126(4), 266-270.
9. Ersoy H, Steigner ML, Coyner KB, Gerhard-Herman MD, Rybiciki FJ, Bueno R, Nguyen LL. Vascular thoracic outlet syndrome: Protocol design and diagnostic value of contrast-enhanced 3D MR angiography equlibrium phase imaging on 1,5- and 3-T MRI Scans. AJR 2012;198:1180-1187.
10. Gómez E, Bastida R, Oleaga L, Gorriño M, Grande D. Diagnóstico por angiorresonancia magnética del síndrome del estrecho torácico superior. Radiología. 2006;48(5):295-300.
11. Hasanadka, R., Towne, J. B., Seabrook, G. R., Brown, K. R., Lewis, B. D., & Foley, W. D. Computed tomography angiography to evaluate thoracic outlet neurovascular compression. Vasc Endovascular Surg 2007; 41(4), 316-321.
12. Horton, K. M., & Fishman, E. K. Multidetector CT angiography in the diagnosis of mesenteric ischemia. Radiol Clin North Am 2007; 45(2), 275-288.
13. Kanal, E., Barkovich, A. J., Bell, C., Borgstede, J. P., Bradley, W. G., Froelich, J. W., Lester, J. W. ACR guidance document on MR safe practices: 2013. J Magn Reson Imaging 2013, 37(3), 501-530.
14. Kau T, Eicher W, Reiterer C, Niedermayer M, Rabitsch E, Senft B, et al. Dual-energy CT angiography in peripheral arterial occlusive disease-accuracy of maximum intensity projections in clinical routine and subgroup analysis. Eur Radiol. 2011;21:1677-86.
15. Karçaaltincaba, M., & Aktas, A. Dual-energy CT revisited with multidetector CT: review of principles and clinical applications. Diagn Interven Radiol 2011; 17(3), 181.
16. Kirkpatrick, I. D., Kroeker, M. A., & Greenberg, H. M. Biphasic CT with mesenteric CT angiography in the evaluation of acute mesenteric ischemia: initial experience 1. Radiology 2003, 229(1), 91-98.
17. Lee, V. S. Cardiovascular MRI: physical principles to practical protocols. 2006; Lippincott Williams & Wilkins.
18. Mallouhi, A., Rieger, M., Czermak, B., Freund, M. C., Waldenberger, P., & Jaschke, W. R. Volume-rendered multidetector CT angiography: noninvasive follow-up of patients treated with renal artery stents. AJR Am J Roentgenol 2003; 180(1), 233-239.
19. Manghat, N. E., Morgan-Hughes, G. J., & Roobottom, C. A. Multi-detector row computed tomography: imaging in acute aortic syndrome. Clin Radiol 2005; 60(12), 1256-1267.
20. Martin, M. L., Tay, K. H., Flak, B., Fry, P. D., Doyle, D. L., Taylor, D. C., Machan, L. S. Multidetector CT angiography of the aortoiliac system and lower extremities: a prospective comparison with digital subtraction angiography. AJR Am AJR Am J Roentgenol 2003; 180(4), 1085-1091.
21. McMahon, M. A., & Squirrell, C. A. Multidetector CT of Aortic Dissection: A Pictorial Review 1. Radiographics 2010; 30(2), 445-460.
22. Met R., Bipat S., Legemate D.A., Leekers J. A., Koelemay MJ.Diagnostic performance of computed tomography angiography in peripheral arterial disease: a systematic review and meta-analysis.JAMA 2009; 28;301(4):415-24.
23. Nael, K., Villablanca, J. P., Pope, W. B., McNamara, T. O., Laub, G., & Finn, J. P.. Supraaortic arteries: contrast-enhanced MR angiography at 3.0 T—highly accelerated parallel acquisition for improved spatial resolution over an extended field of view 1. Radiology 2007; 242(2), 600-609.
24. Oleaga L. Z., Lafuente J. M. Aprendiendo los fundamentos de la resonancia magnética 2006 Médica Panamericana.
25. Provenzale JM, Sarikaya B. Comparison of test performance characteristics of MRI, MR angiography, and CT angiography in the diagnosis of carotida and vertebral artery dissection: are view of the medical literature. AJR Am J Roentgenol 2009 ;193(4):1167-74.
26. Rakita, D., Newatia, A., Hines, J. J., Siegel, D. N., & Friedman, B. (2007). Spectrum of CT findings in rupture and impending rupture of abdominal aortic aneurysms 1. Radiographics, 27(2), 497-507.
27. Raman, S. P., Mahesh, M., Blasko, R. V., & Fishman, E. K. (2013). CT scan parameters and radiation dose: practical advice for radiologists. J Am Coll Radiol 2013;10(11), 840-846.
28. Roos, J. E., Willmann, J. K., Weishaupt, D., Lachat, M., Marincek, B., & Hilfiker, P. R. . Thoracic aorta: motion artifact reduction with retrospective and prospective electrocardiography-assisted multi–detector row CT 1. Radiology 2002; 222(1), 271-277.
29. Rydberg J, Buckwalter KA, Caldemeyer KS, Phillips MD, Conces DJ Jr, Aisen AM et al. Multisection CT: scanning techniques and clinical applications. Radiographics. 2000; 20(6):1787-806.
30. Saba, L., Sanfilippo, R., Pascalis, L., Montisci, R., Caddeo, G., & Mallarini, G. Carotid artery wall thickness and ischemic symptoms: evaluation using multi-detector-row CT angiography. Eur Radiol 2008; 18(9), 1962-1971.
31. Sagara Y, Hara AK, Pavlicek W, Silva AC, Paden RG, Wu Q. Abdominal CT: comparison of low-dose CT with adaptive statistical iterative reconstruction and routine-dose CT with filtered back rojection in 53 Patients. AJR Am J Roentgenol 2010;195:713-9
32. Salvolini, L., Renda, P., Fiore, D., Scaglione, M., Piccoli, G., & Giovagnoni, A. Acute aortic syndromes: role of multi-detector row CT. Eur J Radiol 2008; 65(3), 350-358.
33. Schoepf, U. J., & Costello, P. CT angiography for diagnosis of pulmonary embolism: state of the Art 1. Radiology 2004; 230(2), 329-337.
34. Tan, K. T., Van Beek, E. J. R., Brown, P. W. G., Van Delden, O. M., Tijssen, J., & Ramsay, L. E. Magnetic resonance angiography for the diagnosis of renal artery stenosis: a meta-analysis. Clin Radiol 2002; 57(7), 617-624.
35. Thieme SF, Ashoori N, Bamberg F, Sommer WH, Johnson TR, Leuchte H, et al. Severity assessment of pulmonary embolism using dual energy CT-correlation of a pulmonary perfusion defect score with clinical and morphological parameters of blood oxygenation and right ventricular failure. Eur Radiol. 2012;22:269-78.
36. Weston J, Physics & Technology of Multi-slice CT. ImPACT. http://www.impactscan.org